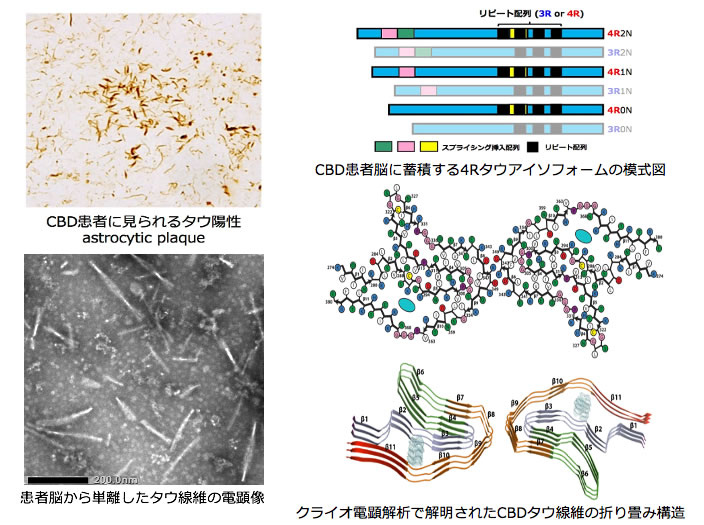
大脳皮質基底核変性症(CBD)のタウ線維の折りたたみ構造
東京都医学総合研究所 認知症プロジェクト
長谷川成人
Zhang W, Tarutani A, Newell KL, Murzin AG, Matsubara T, Falcon B, Vidal R, Garringer HJ, Zhang W, Tarutani A, Newell K, Murzin A, Matsubara T, Falcon B, Vidal R, Garringer H, Shi Y, Ikeuchi T, Murayama S, Ghetti B, Hasegawa M, Goedert M, Scheres SHW.
Novel tau filament fold in corticobasal degeneration.
Nature, 2020, 580, 283-287. Doi: 10.1038/s41586-020-2043-0.
https://www.nature.com/articles/s41586-020-2043-0
大脳皮質基底核変性症(CBD)は、40歳以降に発病し、パーキンソン症状と大脳皮質症状が同時にみられる難治性の神経変性疾患である。神経病理学的には4リピート(4R)タウが神経細胞やグリア細胞内に蓄積するタウオパチーの一種で、疾患を定義づける病変としてastrocytic plaqueの出現が認められる。類似の4Rタウオパチーである進行性核上性麻痺(PSP)とはタウの蓄積形態や分布に加え、不溶化タウのバンドパターンが異なる。また、3リピート(3R)タウが線維化、蓄積するピック病や、3Rタウと4Rタウの両方が蓄積するアルツハイマー病とも組織学的、生化学的に区別される。しかしながら診断が難しい上、生化学マーカーもなく、有効な治療法は確立されていない。
今回、神経病理診断の正確さと凍結組織の保存状態の良さから、日本ブレインバンクネットに共同研究を申請し、患者剖検脳の凍結脳組織の提供を受けた。CBD患者脳に蓄積するタウ線維のクライオ電顕解析を行い、その構造を決定するため、電顕解析に適した試料を剖検脳組織から精製する様々な方法を東京都医学総合研究所において検討した。分画試料の電子顕微鏡観察を行うと共に、異常タウを検出する生化学解析を並行して行うことで、精製度の高いタウ線維を効率よく、また回収率よく調製する方法を確立した。免疫電顕と生化学解析データを取得した精製タウ線維試料をMRCに送り、共同研究としてクライオ電顕解析を行った。その結果、2.8Å~3.2Åの解像度でCBDタウ線維の構造が解かれた。日本ブレインバンクネットの症例2例と米国の1例の3例のCBD患者脳のタウ線維は、いずれも同一のタウの折りたたみ構造を示し、それはアルツハイマー病やピック病のタウとは異なっていた。タウのリジン274からグルタミン酸380までの残基で構成された新規のおりたたみ構造で、微小管結合領域にあたる繰り返し配列R1の最後の残基からR2、R3、R4の全体に加えR4後の12アミノ酸を含む4層の折りたたみ構造をとり、中央部には非タンパク質性コファクターが存在していた。このコファクターは、R2のリジン290とリジン294残基の側鎖、R4後の配列のリジン370の側鎖で囲まれており、負電荷分子であることが示唆された。CBD患者から精製したタウ線維は培養細胞に導入すると細胞内の正常タウを異常型に変換するプリオン様性質を有していた。今回の解析により、世界ではじめて4Rタウオパチー患者脳に蓄積するタウの折りたたみ構造を明らかにすることができた。今回の結果は、脳内で異常型となったタウがプリオン様性質を獲得し、伝播して広がる仮説を支持するものであり、得られた構造情報は、タウオパチーの診断プローブ開発やタウを標的とした治療法開発に役立つことが期待される。