最近の研究
投稿を希望される方は、左の日本植物形態学会ウェブサイト担当<kuri[at]bio.nagoya-u.ac.jp>までご連絡ください。折り返し投稿フォームをお送りします。
長期の過重力暴露はシロイヌナズナの茎において細胞の数とサイズとリグニン蓄積を促進する
富山大学

シロイヌナズナの一次花序の主軸を、8 × g の過重力環境下で10日間成長させた結果、主軸は短く太くなりリグニン蓄積が促進され、主軸横断面の多くの組織の大きさが増加し、木部や形成層では細胞数も増加していました。これらは過重力下では様々な茎を強化する反応が生じることを示唆しています。
【論文情報】
タイトル:Prolonged exposure to hypergravity increases number and size of cells and enhances lignin deposition in the stem of Arabidopsis thaliana.
著者:Hironori Shinohara, Masaki Muramoto, Daisuke Tamaoki, Hiroyuki Kamachi, Hiroshi Inoue, Atsushi Kume, Ichirou Karahara
雑誌名:Journal of Plant Research
DOI: 10.1007/s10265-024-01556-x
テッポウユリ雄原細胞におけるクロマチン構造と転写活性領域の核内ダイナミクス
山形大学
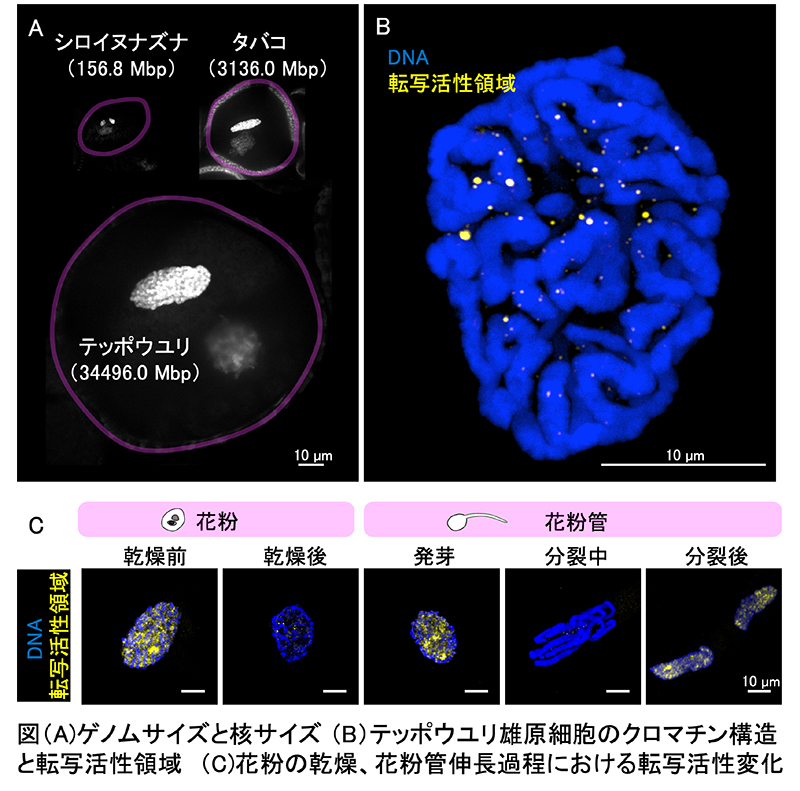
本研究では、テッポウユリの大きな雄原細胞を用いて、クロマチン構造と転写が行われている領域を詳しく観察しました。その結果、花粉の成熟に伴いクロマチンがリボン状に凝集し、転写活性領域はその隙間に限定されることがわかりました。さらに、花粉の乾燥、花粉管の伸長過程で転写レベルが大きく変動することも明らかになりました。
【論文情報】
タイトル:Dynamic changes in chromatin structure and transcriptional activity in the generative cells of Lilium longiflorumArabidopsis thaliana.
著者:Mio K. Shibuta, Tsugumi Aso, Yutsuki Okawa
雑誌名:Journal of Plant Research
DOI: 10.1007/s10265-025-01637-5
病気に強くても老けやすい? 植物の葉の老化を促す新因子を発見
大阪公立大学

播種後49日間育てた野生型のシロイヌナズナとADF欠損変異体の葉を並べた写真。左が最も古い葉で、右が最も若い葉。野生型の葉では全ての葉が緑色をしているが、ADF欠損変異体では左の古い葉はすでに枯死しており、それ以降の葉も黄化が進んでいる。枯死、黄化部分を白矢印で示す。
詳しくは、プレスリリース大阪公立大学(2025年5月30日)『病気に強くても老けやすい?植物の葉の老化を促す新因子を発見』をご覧ください。
【論文情報】
タイトル:Arabidopsis thaliana ACTIN DEPOLYMERIZING FACTORs play a role in leaf senescence regulation.
著者:Tomoko Matsumoto, Koichi Kobayashi, Noriko Inada
雑誌名:Plant and Cell Physiology
DOI: 10.1093/pcp/pcaf027
花粉の非対称分裂における細胞骨格の役割
名古屋大学
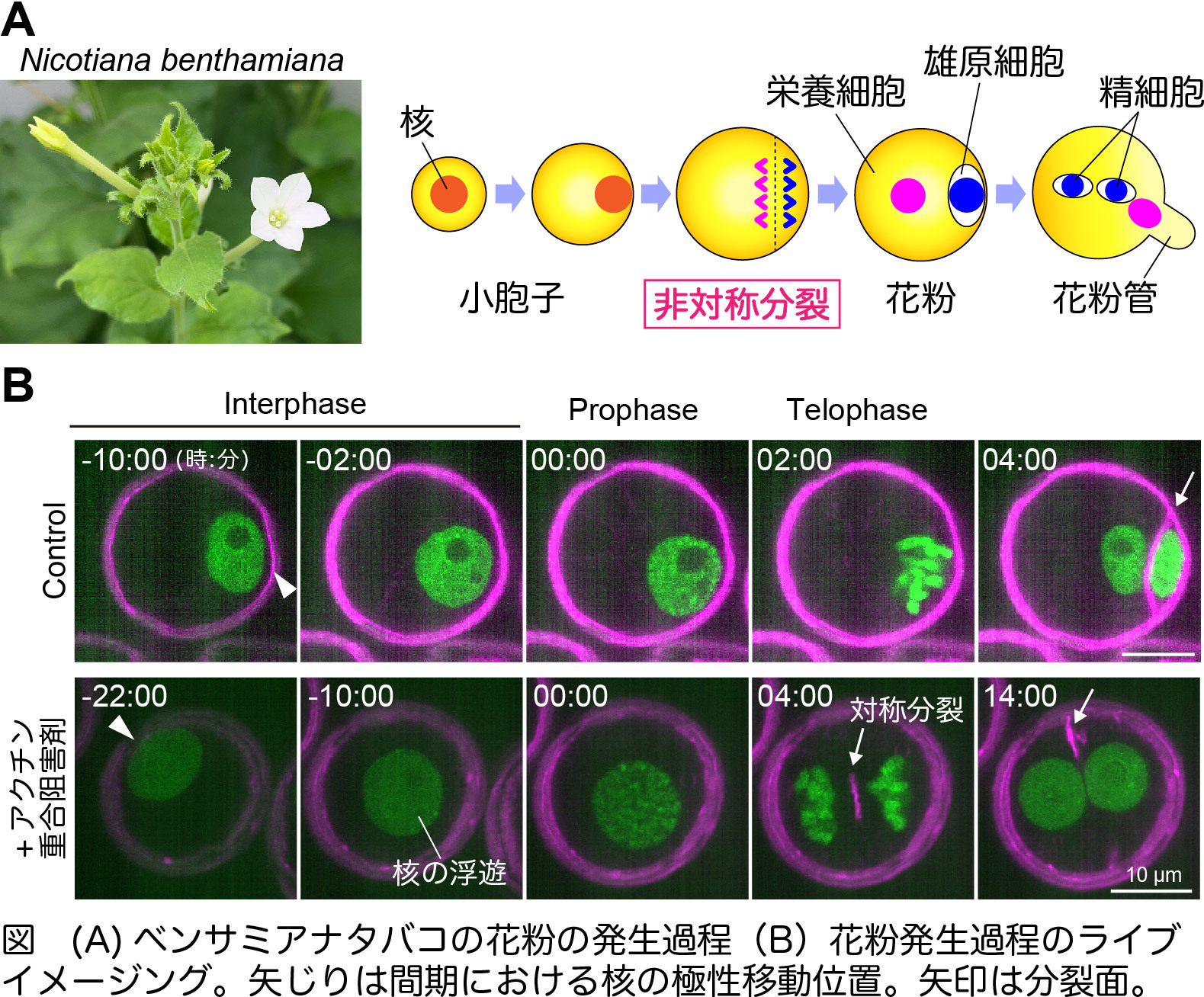
被子植物では小胞子が非対称分裂し、それぞれ栄養細胞と雄原細胞に分化することで花粉が作られます。本研究ではベンサミアナタバコの花粉発生過程を生体外でライブイメージングする方法を確立することで、アクチン繊維が核の極性移動と肥大を制御し、非対称分裂と分化に重要な役割を持つことを明らかにしました。
【論文情報】
タイトル:In vitro live cell imaging reveals nuclear dynamics and role of the cytoskeleton during asymmetric division of pollen mitosis I in Nicotiana Benthamiana
著者:Yoko Mizuta, Masako Igarashi, Tomomi Shinagawa, Ikuma Kaneshiro, Haoto Anan, Daisuke Kurihara
雑誌名:Cytoskeleton
DOI: 10.1002/cm.70003
動物培養細胞内に葉緑体を導入して光合成の初期反応を検出
東京大学

紅藻のシゾンから光合成活性を維持した葉緑体を単離して、その葉緑体をハムスター卵巣培養細胞に移植することに成功した。超解像顕微鏡により解析すると、葉緑体が細胞質に2個から6個維持されていた。青緑は細胞核、黄緑は膜構造を持った細胞内小器官、赤紫は葉緑体を示す。葉緑体内部の中央部分には葉緑体DNAが観察される。
詳しくは、プレスリリース東京大学(2024年10月31日)『光合成活性を持つ葉緑体を動物細胞に移植することに成功 ―光合成可能な動物細胞作製の突破口を開く―』をご覧ください。
【論文情報】
タイトル:Incorporation of photosynthetically active algal chloroplasts in cultured mammalian cells towards photosynthesis in animals.
著者:Ryota Aoki, Yayoi Inui, Yoji Okabe, Mayuko Sato, Noriko Takeda-Kamiya, Kiminori Toyooka, Koki Sawada, Hayato Mortita, Baptiste Genot, Shinichiro Maruyama, Tatsuya Tomo, Kintake Sonoike, Sachihiro Matsunaga
雑誌名:Proceedings of the Japan Academy, Series B, Physical and Biological Sciences
DOI: 10.2183/pjab.100.035
ヒメツリガネゴケをモデルとしてメスの生殖器官発生を運命づける転写因子PpRKDの同定に成功
立教大学

植物には、同一個体にオスとメスの両方の生殖器官をつくる種が存在します。コケ植物のヒメツリガネゴケでは、茎葉体と呼ばれる茎葉構造の頂端に、先にオスの生殖器官が発生し、後からメスの生殖器官が発生しますが、どちらの生殖器官をつくるのかが厳密に制御されています。本研究では、メスの生殖器官の発生を運命づける転写因子PpRKDの同定に成功しました。
詳しくは、プレスリリース立教大学(2024年11月22日)『ヒメツリガネゴケをモデルとしてメスの生殖器官発生を運命づける転写因子PpRKDの同定に成功』をご覧ください。
【論文情報】
タイトル:The transcription factor PpRKD evokes female developmental fate in the sexual reproductive organs of Physcomitrium patens
著者:Emiko Yoro, Seiya Suzuki, Nobuhiro Akiyoshi, Rumiko Kofuji, Keiko Sakakibara
雑誌名:New Phytologist
DOI: 10.1111/nph.20262
植物が自ら傷口を修復する時の細胞増殖の仕組みを解明
帝京大学

本研究では、マトリックスメタロプロテアーゼ(MMP)の一種である酵素At2-MMPが、切断されたシロイヌナズナ花茎の組織修復プロセスにおいて、細胞増殖の抑制メカニズムに重要であることを示した。At2-MMPの遺伝子発現は、切断後0日目から5日目にかけて徐々に増加し、7日目には減少する。切断後7日目の切断花茎を観察した結果、At2-MMPが欠損した変異体(at2-mmp 変異体)では、切断部における異常な細胞増殖が促進されていた。
詳しくは、プレスリリース帝京大学(2024年9月19日)『植物が自ら傷口を修復する時の細胞増殖の仕組みを解明』をご覧ください。
【論文情報】
タイトル:At2-MMP is required for attenuation of cell proliferation during wound healing in incised Arabidopsis inflorescence stems
著者:Afiifah Machfuudzoh, Weerasak Pitaksaringkarn, Ryo Koshiba, Takumi Higaki, Randeep Rakwal, Yusuke Ohba, Masashi Asahina, Shinobu Satoh, Hiroaki Iwai
雑誌名:Plant and Cell Physiology
DOI: 10.1093/pcp/pcae103
植物の「内と外」を最初に作る仕組みを発見
〜細胞はかたちを少し変えることで分裂の方向を決めている〜
東北大学

本研究では、シロイヌナズナの内外軸(A)の形成が損なわれる変異体(B)を見出しました。さらに、ライブイメージング(C)とシミュレーション解析(D)を組み合わせ、「核の中心を通り、かつ面積が最小になる分裂面」が選ばれることで左右分裂が誘導され、これが内外軸形成の端緒となることが分かりました。
詳しくは、プレスリリース東北大学(2024年9月20日)『植物の「内と外」を最初に作る仕組みを発見 〜細胞はかたちを少し変えることで分裂の方向を決めている〜』をご覧ください。
【論文情報】
タイトル:HD-ZIP IV genes are essential for embryo initial cell polarization in the radial axis initiation in Arabidopsis
著者:Sayuri Tanaka, Yuuki Matsushita, Yuga Hanaki, Takumi Higaki, Naoya Kamamoto, Katsuyoshi Matsushita, Tetsuya Higashiyama, Koichi Fujimoto, Minako Ueda
雑誌名:Current Biology
DOI: 10.1016/j.cub.2024.08.038
見えた!植物がたくさん種子を作るしくみ
〜二光子顕微鏡で見る多精拒否のライブイメージング〜
名古屋大学

二光子顕微鏡でシロイヌナズナのめしべの中をライブイメージングし、花粉管が胚珠に1対1で誘引される様子を捉えることに成功しました。胚珠に由来する誘引・接着シグナルと、2本目の花粉管を拒否するシグナルが多段階に働くことで多精拒否が成立し、効率的により多くの種子を作るしくみが明らかになりました。
詳しくは、プレスリリース名古屋大学(2024年5月22日)『見えた!植物がたくさん種子を作るしくみ ~花の中身を観察する新手法で、オスとメスが結ばれるしくみ究明~』をご覧ください。
【論文情報】
タイトル:Deep imaging reveals dynamics and signaling in one-to-one pollen tube guidance
著者:Yoko Mizuta, Daigo Sakakibara, Shiori Nagahara, Ikuma Kaneshiro, Takuya T. Nagae, Daisuke Kurihara, Tetsuya Higashiyama
雑誌名:EMBO reports
DOI: 10.1038/s44319-024-00151-4
シバの葉は表側だけ塩を出す
〜葉の向背軸間の表皮形態を電子顕微鏡レベルで詳細比較〜
名古屋大学(現所属 高知工科大学)

イネ科ヒゲシバ亜科の耐塩性種には、葉表皮の小毛から塩を排出するものがあります (塩腺)。しかし、シバ (Zoysia japonica) においては葉の表 (向軸側) では塩の排出が見られるのに、裏 (背軸側) では見られません。本研究では電子顕微鏡観察によって裏側の小毛にも発達した内部構造があり、塩排出以外の働きをしている可能性を示しました。
【論文情報】
タイトル:Morphology and excreting-function of microhairs in salt-tolerant Zoysia japonica, comparing adaxial and abaxial leaf surfaces
著者:Masahiro Koyama, Takao Oi
雑誌名:Flora
DOI: 10.1016/j.flora.2024.152472
植物の精細胞放出を制御する簡便な方法を開発
〜重複受精における精細胞活性化機構の解明に期待〜
横浜市立大学

本研究では、青色光を照射するという非常に簡便な操作でシロイヌナズナの花粉管に対して破裂を効率よく誘導できることを示しました (A)。この現象は他の植物種の花粉管でも見られること(B)、そして青色光照射は花粉管に対してカルシウムイオンの流入を引き起こすことも明らかにしました(C)。
詳しくは、プレスリリース横浜市立大学(2024年3月18日)『植物の精細胞放出を制御する簡便な方法を開発 〜重複受精における精細胞活性化機構の解明に期待〜』をご覧ください。
【論文情報】
タイトル:Blue light irradiation induces pollen tube rupture in various flowering plants
著者:Naoya Sugi, Daichi Susaki, Yoko Mizuta, Tetsu Kinoshita, Daisuke Maruyama
雑誌名:Plant and Cell Physiology
DOI: 10.1093/pcp/pcae018
見逃されてきた“非典型”転写因子がコケ植物の有性生殖器官の発生を制御する
立命館大学(現所属 大阪大学)

本研究ではコケ植物ゼニゴケの有性生殖器官の発生に関わる因子を探索し、“非典型”BZR/BES転写因子であるMpBZR3が造卵器と造精器の発生に重要な役割をもつことを明らかにしました。写真はMpBZR3を過剰発現したゼニゴケでみられる異所的に誘導された造精器。
詳しくは、プレスリリース立命館大学(2024年4月11日)『見逃されてきた“非典型”転写因子がコケ植物の有性生殖器官の発生を制御する 植物の有性生殖システムの進化の痕跡を示す鍵因子の発見』をご覧ください。
【論文情報】
タイトル:A non-canonical BZR/BES transcription factor regulates the development of haploid reproductive organs in Marchantia polymorpha
著者:Tomoyuki Furuya, Natsumi Saegusa, Shohei Yamaoka, Yuki Tomoita, Naoki Minamino, Masaki Niwa, Keisuke Inoue, Chiaki Yamamoto, Kazuki Motomura, Shunji Shimadzu, Ryuichi Nishihama, Kimitsune Ishizaki, Takashi Ueda, Hidehiro Fukaki, Takayuki Kohchi, Hiroo Fukuda, Masahiro Kasahara, Takashi Araki, Yuki Kondo
雑誌名:Nature Plants
DOI: 10.1038/s41477-024-01669-0
光合成にかかわる脂質の機能解明が大きく前進!
モヤシが葉緑体をつくるためのカギは「酸性リン脂質」
1日本女子大学、2大阪公立大学

暗所で生育した被子植物の色素体には、規則的な膜構造のプロラメラボディが形成されます。酸性リン脂質PGの合成が低下したpgp1-1では、プロラメラボディが緩み不規則な構造を示しました。本研究では、PGがプロラメラボディの形成やクロロフィル中間体の合成に必要であること、またSQDGがPGの役割を一部補うことを明らかにしました。
詳しくは、プレスリリース大阪公立大学(2024年1月19日)『光合成にかかわる脂質の機能解明が大きく前進! モヤシが葉緑体をつくるためのカギは「酸性リン脂質」』をご覧ください。
【論文情報】
タイトル:Anionic lipids facilitate membrane development and protochlorophyllide biosynthesis in etioplasts
著者:Akiko Yoshihara, Keiko Kobayashi, Noriko Nagata, Sho Fujii, Hajime Wada and Koichi Kobayashi
雑誌名:Plant Physiology
DOI: 10.1093/plphys/kiad604
オスの性染色体だけでバイセクシュアル種へ進化する:
緑藻ボルボックスの非モデル種の全ゲノム解析で解明
国立環境研究所

バイセクシュアル種の緑藻ボルボックス・アフリカヌスは、琵琶湖産株を用いた先行研究により、雌雄異株の祖先種のメスが重要なオス特異的遺伝子を取り込むことで進化したと考えられていました。本研究で新たにタイ国産株の全ゲノムを解析した結果、本株は琵琶湖産株とは異なり、メスの性染色体に相当する部分を全て欠き、オスの性染色体に相当する部分だけを引き継いでいることが明らかになりました。
詳しくは、プレスリリース国立環境研究所(2023年6月22日)『オスの性染色体だけでバイセクシュアル種へ進化する:緑藻ボルボックスの非モデル種の全ゲノム解析で解明』をご覧ください。
【論文情報】
タイトル:Expanded male sex-determining region conserved during the evolution of homothallism in the green alga Volvox
著者:Kayoko Yamamoto, Ryo Matsuzaki, Wuttipong Mahakham, Wirawan Heman, Hiroyuki Sekimoto, Masanobu Kawachi, Yohei Minakuchi, Atsushi Toyoda, Hisayoshi Nozaki
雑誌名:iScience
DOI: 10.1016/j.isci.2023.106893
3つの性別の共存はいかにして可能か?
〜緑藻プレオドリナ・スターリーにおける「性染色体革命」〜
東京大学

本研究では、3つの性別を持つ緑藻プレオドリナ・スターリーにおける全ゲノム解読を行いました。その結果、本種の3つの性別は祖先種の性染色体を構成する性決定領域の大規模な再編成の結果誕生したことを明らかにしました。
詳しくは、プレスリリース東京大学(2023年6月9日)『メス、オス、バイセクシュアルの共存への性染色体革命――新規全ゲノム解読が性別3種類共存の頑強性を支持――』をご覧ください。
【論文情報】
タイトル:Reorganization of the ancestral sex-determining regions during the evolution of trioecy in Pleodorina starrii
著者:Kohei Takahashi, Shigekatsu Suzuki, Hiroko Kawai-Toyooka, Kayoko Yamamoto, Takashi Hamaji, Ryo Ootsuki, Haruyo Yamaguchi, Masanobu Kawachi, Tetsuya Higashiyama, Hisayoshi Nozaki
雑誌名:Communications Biology
DOI: 10.1038/s42003-023-04949-1
維管束が花茎器官の丈夫さに貢献することを証明
神奈川大学、東京学芸大学

今回私たちは、シロイヌナズナの花茎の内部に位置する維管束組織が成長過程において果たす力学的な役割について調べました。まず私たちは大規模なスクリーニングによって、花茎に亀裂が生じる系統を新たに単離することに成功しました(A、B)。そしてこの系統を活用し、花茎の内部を構成する各組織・細胞形態を詳細に解析しました。その結果、花茎内部における維管束の数や配置などが、花茎の「力学的最適化」を支える重要な要素であることを見出しました(C、D)。
詳しくは、プレスリリース東京学芸大学(2023年2月7日)『維管束が茎器官の丈夫さに貢献することを証明』をご覧ください。
【論文情報】
タイトル:Contribution of vasculature to stem integrity in Arabidopsis thaliana
著者:Mariko Asaoka, Shingo Sakamoto, Shizuka Gunji, Nobutaka Mitsuda, Hirokazu Tsukaya, Shinichiro Sawa, Olivier Hamant, Ali Ferjani
雑誌名:Development
DOI: 10.1242/dev.201156
植物の精細胞が「一皮むけた」瞬間を撮影
~重複受精の精巧な仕組みの一端を明らかに~
横浜市立大学

本研究では、花粉管の放出直後に2つ1組の精細胞を覆っていた内部形質膜が崩壊する様子をライブイメージングしました(YouTubeで動画をご覧になれます)。この内部形質膜崩壊は精細胞を露出させることで素早い雌雄の配偶子融合に寄与していると考えられます。
詳しくは、プレスリリース横浜市立大学(2023年3月8日)『植物の精細胞が「一皮むけた」瞬間を撮影 〜重複受精の精巧な仕組みの一端を明らかに〜』をご覧ください。
【論文情報】
タイトル:Removal of the endoplasma membrane upon sperm cell activation after pollen tube discharge
著者:Naoya Sugi, Rie Izumi, Shun Tomomi, Daichi Susaki, Tetsu Kinoshita, Daisuke Maruyama
雑誌名:Frontiers in Plant Science
DOI: 10.3389/fpls.2023.1116289
植物の細胞分裂を阻害する新たな薬剤を発見
~コケ植物から被子植物まで、多様な植物種に効果あり~
東北大学

シロイヌナズナの受精卵を使った化合物スクリーニングによって、微小管の配向や細胞板の形成を阻害する新規薬剤を見つけました。これらの薬剤は、ヒメツリガネゴケやタバコなど、多様な植物種に効果を発揮することから、細胞分裂に関するさまざまな研究への利用が期待されます。
詳しくは、プレスリリース東北大学(2023年2月28日)『植物の細胞分裂を阻害する新たな薬剤を発見~コケ植物から被子植物まで、多様な植物種に効果あり~』をご覧ください。
【論文情報】
タイトル:Novel inhibitors of microtubule organization and phragmoplast formation in diverse plant species
著者:Yusuke Kimata, Moé Yamada, Takashi Murata, Keiko Kuwata, Ayato Sato, Takamasa Suzuki, Daisuke Kurihara, Mitsuyasu Hasebe, Tetsuya Higashiyama, Minako Ueda
雑誌名:Life Science Alliance
DOI: 10.26508/lsa.202201657
アクチン繊維が花粉管の誘引を制御する
~助細胞による誘引ペプチド分泌のメカニズムを解明~
横浜市立大学

本研究では、助細胞のアクチン繊維が花粉管誘引ペプチドの極性分泌を担っていることを解明した。雌しべの胚珠にある助細胞は、繊形装置とよばれる細胞膜と細胞壁が複雑に陥入した特殊な構造から誘引ペプチドを分泌するが、その分泌の仕組みは明らかでなかった。助細胞でアクチン重合を阻害すると誘引ペプチドの局在が変化して、稔性が低下した。
詳しくは、プレスリリース横浜市立大学(2023年1月12日)『アクチン繊維が花粉管の誘引を制御する~助細胞による誘引ペプチド分泌のメカニズムを解明~』をご覧ください。
【論文情報】
タイトル:F-actin regulates polarized secretion of pollen tube attractants in Arabidopsis synergid cells
著者:Daichi Susaki, Rie Izumi, Takao Oi, Hidenori Takeuchi, Ji Min Shin, Naoya Sugi, Tetsu Kinoshita, Tetsuya Higashiyama, Tomokazu Kawashima, Daisuke Maruyama
雑誌名:The Plant Cell
DOI: 10.1093/plcell/koac371
気孔のない植物タイ類における気孔形成因子の役割を解明
―コケ植物特有の組織「蒴柄(さくへい)」と気孔の意外な関係―
京都大学

気孔のないコケ植物ゼニゴケに気孔形成因子の相同遺伝子が存在し、コケ植物特有の組織である「蒴柄(さくへい)」という、気孔とは形も生理学的な機能も異なる組織の形成を制御することを明らかにしました。本研究により、これまで想定されていなかった、気孔と蒴柄の発生メカニズムが共通するという可能性が見出されました。
詳しくは、プレスリリース京都大学・東京理科大学(2023年1月20日)『気孔のない植物タイ類における気孔形成因子の役割を解明―コケ植物特有の組織「蒴柄(さくへい)」と気孔の意外な関係―』をご覧ください。
【論文情報】
タイトル:Stomatal regulators are co-opted for seta development in the astomatous liverwort Marchantia polymorpha
著者:Kenta C. Moriya, Makoto Shirakawa, Jeanne Loue-Manifel, Yoriko Matsuda, Yen-Ting Lu, Kentaro Tamura, Yoshito Oka, Tomonao Matsushita, Ikuko Hara-Nishimura, Gwyneth Ingram, Ryuichi Nishihama, Justin Goodrich, Takayuki Kohchi, Tomoo Shimada
雑誌名:Nature Plants
DOI: 10.1038/s41477-022-01325-5
花びらの形が葉と違う仕組みを解明
東京大学

葉、花弁、萼の形の違いと細胞分裂の場所の違い。上段は左から葉、花弁、萼の原基。グレーのドットは一つ一つが分裂中の細胞。下段は数理シミュレーションの結果の一部。赤い場所で細胞が活発に増殖している。細胞分裂の位置を変えるだけで、最終的な器官の形が大きく変化する。もっとも花弁らしい形になったのは、先端近くである程度の広がりをもって細胞分裂する場合(左から2番め)であった。
詳しくは、プレスリリース東京大学(2022年12月12日)『花びらの形が葉と違う仕組みを解明』をご覧ください。
【論文情報】
タイトル:Position of meristems and the angles of the cell division plane regulate the uniqueness of lateral organ shape
著者:Ayaka Kinoshita, Makiko Naito, Zining Wang, Yasuhiro Inoue, Atsushi Mochizuki, and Hirokazu Tsukaya
雑誌名:Development
DOI: 10.1242/dev.199773
ヤブカラシの花色は3度変わる
東京大学

ヤブカラシの花色の変化。花の縦断面で示す。左から開花直後のオスの段階、雄しべが脱離した第一休止段階、雌しべが新調したメスの段階、そして雌しべも老化した最終段階。オスの段階とメスの段階だけオレンジ色を示し、他の段階ではピンク色をしている。花の中心にある柱状のものが雌しべ。
詳しくは、プレスリリース東京大学(2022年12月1日)『ヤブカラシの花色は3度変わる』をご覧ください。
【論文情報】
タイトル:Oscillating flower colour changes of Causonis japonica (Thunb.) Raf. (Vitaceae) linked to sexual phase changes
著者:Yukiko Furukawa, Hirokazu Tsukaya, Nobumitsu Kawakubo
雑誌名:Scientific Reports
DOI: 10.1038/s41598-022-24252-z
連続切片-光学顕微鏡法による三次元再構築でイネ葉組織構造を3D解析
名古屋大学

複雑な細胞形状をもつイネ葉身の葉肉組織を固定・包埋し、ミクロトームで0.5 µm間隔に100~200枚の連続切片にして順々に光顕で撮影し、画像解析ソフト上で三次元再構築して立体像を得た。さらに再抽出された二次元の縦断面と横断面から輪郭線を抽出し、細胞間隙に面する葉肉細胞や葉緑体の表面積を推定し、3D実測値と比較した。
詳しくは、プレスリリース名古屋大学(2023年1月6日)『葉肉組織、横から見るか? 縦から見るか?~複雑な細胞形状をもつイネ葉構造の解析法を3D観察法で検証~』をご覧ください。
【論文情報】
タイトル:3-D reconstruction of rice leaf tissue for proper estimation of surface area of mesophyll cells and chloroplasts facing intercellular airspaces from 2-D section images
著者:Rachana Ouk, Takao Oi, Daisuke Sugiura, Mitsutaka Taniguchi
雑誌名:Annals of Botany
DOI: 10.1093/aob/mcac133
巨大Y染色体発見から99年目の快挙
―ヒロハノマンテマの性決定遺伝子の同定に成功―
福井県立大学

雌雄異株植物ヒロハノマンテマの両性花変異体を解析し、めしべの発達を抑制する性決定遺伝子(GSFY)を特定した。GSFYはシロイヌナズナのCLV3のホモログであり、シロイヌナズナに導入するとめしべの発達を阻害した(B)。X染色体連鎖パラログは偽遺伝子化しており、これにより性決定遺伝子が獲得されたと考えられる(C)。
詳しくは、プレスリリース福井県立大学・東京大学(2022年9月30日)『巨大Y染色体発見から99年目の快挙―ヒロハノマンテマの性決定遺伝子の同定に成功―』をご覧ください。
【論文情報】
タイトル:A CLAVATA3-like gene acts as a gynoecium suppression function in White Campion
著者:Yusuke Kazama, Moe Kitoh, Taiki Kobayashi, Kotaro Ishii, Marc Krasovec, Yasuo Yasui, Tomoko Abe, Shigeyuki Kawano, Dmitry A Filatov
雑誌名:Molecular Biology and Evolutiony
DOI: 10.1093/molbev/msac195
植物進化の解明と微細藻類の高度な産業利用の促進
~温泉微細藻類ガルデリアの性の発見と高度な遺伝的改変技術~
国立遺伝学研究所

今回の研究により、従来唯一の形態として知られていた細胞壁を有する単細胞紅藻ガルデリアの細胞が2倍体であることが明らかとなった。さらに今回、新たに細胞壁のない1倍体が発見された。細胞壁を持つ2倍体は母細胞壁内に4~32個の娘細胞を形成し、母細胞壁を破ることによって増殖する。1倍体はオタマジャクシ様の細胞が成長し球形となり分裂することで増殖する。
詳しくは、プレスリリース国立遺伝学研究所(2022年10月5日)『植物進化の解明と微細藻類の高度な産業利用の促進~温泉微細藻類ガルデリアの性の発見と高度な遺伝的改変技術~』をご覧ください。
【論文情報】
タイトル:Life cycle and functional genomics of the unicellular red alga Galdieria for elucidating algal and plant evolution and industrial use
著者:Shunsuke Hirooka, Takeshi Itabashi, Takako M. Ichinose, Ryo Onuma, Takayuki Fujiwara, Shota Yamashita, Lin Wei Jong, Reiko Tomita, Atsuko H. Iwane, Shin-ya Miyagishima
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.2210665119
世紀を超えたDNA空間配置の謎を解明
1東京理科大学、2大阪大学、2東京大学

本研究では、コンデンシンII変異株でのセントロメア配置異常の発見を端緒として(A)、シロイヌナズナにおけるセントロメア配置決定メカニズムには、分裂期にコンデンシンIIとLINC複合体が協調してセントロメアを分散させ、間期にCRWNが分散したセントロメアの配置を安定化するという二段階のステップがあることを明らかにした(B)。
詳しくは、プレスリリース東京大学(2022年8月2日)『世紀を超えたDNA空間配置の謎を解明』をご覧ください。
【論文情報】
タイトル:Two-step regulation of centromere distribution by condensin II and the nuclear envelope proteins
著者:Takuya Sakamoto, Yuki Sakamoto, Stefan Grob, Daniel Slane, Tomoe Yamashita, Nanami Ito, Yuka Oko, Tomoya Sugiyama, Takumi Higaki, Seiichiro Hasezawa, Maho Tanaka, Akihiro Matsui, Motoaki Seki, Takamasa Suzuki, Ueli Grossniklaus, Sachihiro Matsunaga
雑誌名:Nature Plants
DOI: 10.1038/s41477-022-01200-3
耐塩性イネ科牧草の葉内元素の局在を可視化!:
Cryo-SEM-EDSによる細胞レベルでの元素定量で見えてきた組織耐性機構
名古屋大学

200 mM NaClを付加した水耕液で栽培した耐塩性イネ科牧草ローズグラスとその葉横断面のCryo-SEM-EDSによる元素マッピング。v: 維管束 (木部柔細胞を含む)、b: 維管束鞘細胞、m: 葉肉細胞、e: 表皮細胞。右のカラーバーはナトリウム (Na)、リン (P)、硫黄 (S)、塩素 (Cl)、カリウム (K)、カルシウム (Ca) 各々の相対濃度を示す。
詳しくは、プレスリリース名古屋大学(2022年2月22日)『耐塩性イネ科牧草の葉内元素の局在を可視化 ~塩水でも育つローズグラスはナトリウムを葉緑体から隔離する~』をご覧ください。
【論文情報】
タイトル:Salt tolerance in relation to elemental concentrations in leaf cell vacuoles and chloroplasts of a C4 monocotyledonous halophyte
著者:Takao Oi, Peta L Clode, Mitsutaka Taniguchi, Timothy D Colmer, Lukasz Kotula
雑誌名:Plant, Cell & Environment
DOI: 10.1111/pce.14279
蛍光タンパク質の蛍光強度を維持したまま組織・器官を透明化できる動植物共通の透明化法開発に成功
1大阪大学、2東京大学

本研究で開発した生体組織透明化手法iTOMEIを用いてシロイヌナズナの芽生え、ゼニゴケの葉状体、マウスの脳切片を透明化した。下段は透明化後の試料を顕微鏡観察した蛍光写真。iTOMEI処理後でも蛍光タンパク質の蛍光は維持されており、試料深部からの微弱な蛍光シグナルを検出できる。
詳しくは、プレスリリース大阪大学(2022年1月13日)『蛍光タンパク質の蛍光強度を維持したまま組織・器官を透明化できる動植物共通の透明化法開発に成功~農作物の品種改良や脳の診断法開発に貢献~』をご覧ください。
【論文情報】
タイトル:Improved clearing method contributes to deep imaging of plant organs
著者:Yuki Sakamoto, Anna Ishimoto, Yuuki Sakai, Moeko Sato, Ryuichi Nishihama, Konami Abe, Yoshitake Sano, Teiichi Furuichi, Hiroyuki Tsuji, Takayuki Kohchi, Sachihiro Matsunaga
雑誌名:Communications Biology
DOI: 10.1038/s42003-021-02955-9
緑藻アストレフォメネの全ゲノム解読から体細胞獲得の複数の進化経路を解明
国立遺伝学研究所

アストレフォメネ(A)は少数の体細胞(B:矢尻、C)をボルボックスとは独立に獲得した多細胞緑藻である。本研究では、アストレフォメネの全ゲノム解読と細胞別RNA-seq解析から、アストレフォメネがボルボックスとは異なる制御機構の進化によって、類似した特徴をもつ体細胞を進化させたことを明らかにした(D)。
詳しくは、プレスリリース東京大学(2021年11月22日)『多細胞個体の「老化死」を獲得する複数の進化経路―4つの体細胞を持つ稀産緑藻アストレフォメネの全ゲノム解読から解明』をご覧ください。
【論文情報】
タイトル:Genome sequencing of the multicellular alga Astrephomene provides insights into convergent evolution of germ‑soma differentiation
著者:Shota Yamashita, Kayoko Yamamoto, Ryo Matsuzaki, Shigekatsu Suzuki, Haruyo Yamaguchi, Shunsuke Hirooka, Yohei Minakuchi, Shin‑ya Miyagishima, Masanobu Kawachi, Atsushi Toyoda, Hisayoshi Nozaki
雑誌名:Scientific Reports
DOI: 10.1038/s41598-021-01521-x
水陸両生の水草ミズハコベが姿を変える仕組みを解明
東京大学

オオバコ科の水草ミズハコベは、同一の個体内でも、陸上で育っている時(A)と水中で育っている時(B)とで大きく異なる形の葉を作る、異形葉性と呼ばれる能力を持つ。本研究では、ミズハコベがどのようにして異なる形の葉の発生を制御しているのかを、植物ホルモンの作用や遺伝子発現の観点から調べ、その仕組みの一端を明らかにした(C)。
詳しくは、プレスリリース東京大学(2021年7月29日)『水陸両生の水草ミズハコベが姿を変える仕組みを解明』をご覧ください。
【論文情報】
タイトル:Identification of the unique molecular framework of heterophylly in the amphibious plant Callitriche palustris L.
著者:Hiroyuki Koga, Mikiko Kojima, Yumiko Takebayashi, Hitoshi Sakakibara, Hirokazu Tsukaya
雑誌名:The Plant Cell
DOI: 10.1093/plcell/koab192
3種類の性別をもつ新規ライフサイクルを長期継続研究から確証
東京大学

長期間にわたる相模川水系のダム湖のフィールド調査と培養・交配実験から緑藻プレオドリナの同一種がメスとオスに加えて両性型の3番目の性表現型を持つことを明らかにした。写真は同水系の相模湖の2013年の調査。この時確立した10株の1株が両性型であった。
詳しくは、プレスリリース東京大学(2021年7月13日)『3タイプの性別を藻類・菌類の同一種内で初めて発見:相模川水系のボルボックス類に潜む両性型3番目の性(sex)』、The University of Tokyo(July 14, 2021)『Species of algae with three sexes that all mate in pairs identified in Japanese river』をご覧ください。
【論文情報】
タイトル:Three sex phenotypes in a haploid algal species give insights into the evolutionary transition to a self-compatible mating system
著者:Kohei Takahashi, Hiroko Kawai-Toyooka, Ryo Ootsuki, Takashi Hamaji, Yuki Tsuchikane, Hiroyuki Sekimoto, Tetsuya Higashiyama, Hisayoshi Nozaki
雑誌名:Evolution
DOI: 10.1111/evo.14306
京の伝統野菜ミブナの育種の歴史を解明!
1名古屋大学、2京都産業大学

今日の伝統野菜であるミズナの葉はギザギザです(図a,b)が、ミブナの葉はヘラ型です(図c,d)。ミブナは、ミズナの栽培の過程で誕生したと考えられていますが、その詳細は不明でした。本研究では、特に葉の形に着目して、ミブナがミズナから分岐して誕生した過程を、遺伝的解析と古文書解析(図e)の組み合わせにより解明しました。
詳しくは、プレスリリース京都産業大学(2021年6月2日)『京の伝統野菜ミブナの育種の歴史を解明!』をご覧ください。
【論文情報】
タイトル:Combination of genetic analysis and ancient literature survey reveals the divergence of traditional Brassica rapa varieties from Kyoto, Japan
著者:Yaichi Kawakatsu, Tomoaki Sakamoto, Hokuto Nakayama, Kaori Kaminoyama, Kaori Igarashi, Masaki Yasugi, Hiroshi Kudoh, Atsushi J. Nagano, Kentaro Yano, Nakao Kubo, Michitaka Notaguchi, Seisuke Kimura
雑誌名:Horticulture Research
DOI: 10.1038/s41438-021-00569-0
細胞内抗体プローブを用いて転写活性化状態の時空間的ダイナミクスの可視化に成功
1東京大学、2東京理科大学

シロイヌナズナに生体内抗体を導入し、 転写の進行状態を示すRNAポリメラーゼII・C末ドメインの2番目のセリンのリン酸化レベルを可視化した。生体内抗体と相対化タンパク質を同時に発現させることで、修飾レベルを色や蛍光強度比で評価し(図a)、転写活性化レベルダイナミクスの時空間的観察に成功した(図b、c)。
詳しくは、プレスリリース山形大学(2021年5月18日)『細胞内抗体プローブを用いて遺伝子の転写が活性化している細胞を生体内で特定することに成功』をご覧ください。
【論文情報】
タイトル:A live imaging system to analyze spatiotemporal dynamics of RNA polymerase II modification in Arabidopsis thaliana
著者:Mio K. Shibuta, Takuya Sakamoto, Tamako Yamaoka, Mayu Yoshikawa, Shusuke Kasamatsu, Noriyoshi Yagi, Satoru Fujimoto, Takamasa Suzuki, Satoshi Uchino, Yuko Sato, Hiroshi Kimura, Sachihiro Matsunaga
雑誌名:Communications Biology
DOI: 10.1038/s42003-021-02106-0
雌雄同体種への進化を性染色体ゲノムから初めて解明
東京大学

雌雄同体種・異体種の緑藻ボルボックス(Volvox)と琵琶湖での現地調査。本研究では2013年に琵琶湖から採集されたボルボックスの日本新産の雌雄同体種(V. africanus)と新種の雌雄異体種(V. reticuliferus)がゲノム解読に用いられた。
詳しくは、プレスリリース東京大学(2021年5月18日)『雌雄同体の新種誕生におけるメスとオスの性染色体の運命 --- 琵琶湖産ボルボックスの全ゲノム情報から解明 ---』をご覧ください。
【論文情報】
タイトル:Three genomes in the algal genus Volvox reveal the fate of a haploid sex-determining region after a transition to homothallism
著者:Kayoko Yamamoto, Takashi Hamaji, Hiroko Kawai-Toyooka, Ryo Matsuzaki, Fumio Takahashi, Yoshiki Nishimura, Masanobu Kawachi, Hideki Noguchi, Yohei Minakuchi, James G. Umen, Atsushi Toyoda, Hisayoshi Nozaki
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.2100712118
花粉管は核がなくても胚珠に辿り着く
JSTさきがけ、立命館大学、名古屋大学

シロイヌナズナを用いて、基部側に核が取り残され、花粉管先端の細胞質中に核が存在しない状態の花粉管の作出に成功した(図a)。この細胞核を除いた花粉管(図c、cals3m +wit1/wit2の花粉管)が、核を持つ正常な花粉管(図b、野生株の花粉管)と同様に、胚珠へ辿り着く能力を保持していることを明らかにした。
詳しくは、プレスリリース立命館大学(2021年4月23日)『花粉管は核がなくても胚珠に辿り着く ~世界で初めて核を持たない花粉管の作出に成功~』をご覧ください。
【論文情報】
タイトル:Persistent directional growth capability in Arabidopsis thaliana pollen tubes after nuclear elimination from the apex
著者:Kazuki Motomura, Hidenori Takeuchi, Michitaka Notaguchi, Haruna Tsuchi, Atsushi Takeda, Tetsu Kinoshita, Tetsuya Higashiyama, Daisuke Maruyama
雑誌名:Nature Communications
DOI: 10.1038/s41467-021-22661-8
葉緑体核様体をコンパクトに折りたたむ「DNAクリップ」の発見
―ミトコンドリアとも共通する普遍的なしくみの解明―
京都大学

葉緑体核様体を折りたたむ因子として、2つのDNA結合ドメインをもつHBD1タンパク質が見つかった。HBD1遺伝子を破壊すると、葉緑体核様体(a:矢印)が分散した(b)。さらにDNAオリガミと原子間力顕微鏡によって、HBD1が葉緑体DNAの架橋(c)や折り曲げ(d)をすることが明らかになった。
詳しくは、プレスリリース京都大学(2021年5月11日)『葉緑体核様体をコンパクトに折りたたむ「DNAクリップ」の発見 -ミトコンドリアとも共通する普遍的なしくみの解明-』をご覧ください。
【論文情報】
タイトル:HBD1 protein with a tandem repeat of two HMG-box domains is a DNA clip to organize chloroplast nucleoids in Chlamydomonas reinhardtii
著者:Mari Takusagawa, Yusuke Kobayashi, Yoichiro Fukao, Kumi Hidaka, Masayuki Endo, Hiroshi Sugiyama, Takashi Hamaji, Yoshinobu Kato, Isamu Miyakawa, Osami Misumi, Toshiharu Shikanai, Yoshiki Nishimura
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.2021053118
植物の卵細胞がつくられる様子を生きたまま観察することに成功
1横浜市立大学、2名古屋大学

シロイヌナズナを用いて卵細胞を含む雌性配偶体の発生過程のリアルタイム観察に成功しました(上図、矢じりは雌性配偶体細胞の核)。また、雌性配偶体内の各種細胞を単離して、少数の細胞で発現する遺伝子を解析する手法を確立し、助細胞特異的転写因子変異体の助細胞が卵細胞へと細胞運命を変化させる様子を明らかにしました(下図、矢印は卵細胞特異的遺伝子を発現する変異体助細胞)。
詳しくは、プレスリリース横浜市立大学・名古屋大学(2021年3月29日)『植物の卵細胞がつくられる様子を生きたまま観察することに成功 ~卵細胞をつくりだし受精を達成する仕組みの解明に期待~』をご覧ください。
【論文情報】
タイトル:Dynamics of the cell fate specifications during female gametophyte development in Arabidopsis
著者:Daichi Susaki, Takamasa Suzuki, Daisuke Maruyama, Minako Ueda, Tetsuya Higashiyama, Daisuke Kurihara
雑誌名:PLoS Biology
DOI: 10.1371/journal.pbio.3001123
植物の「暮らし」によって気孔の作り方が違う仕組みを解明
東京大学

オオバコ科のアワゴケ属には、水中と陸上の両方で生育できる両生種(水草)と、陸上のみで生育する陸生種が存在する。今回の研究では、アワゴケ属において、両生種か陸生種かによって気孔の作り方が異なることを発見した(図)。加えて、この各種で異なるパターンの背後にある遺伝学的な仕組みを明らかにした。
詳しくは、プレスリリース東京大学(2021年3月30日)『植物の「暮らし」によって気孔の作り方が違う仕組みを解明』をご覧ください。
【論文情報】
タイトル:The diversity of stomatal development regulation in Callitriche is related to the intrageneric diversity in lifestyles
著者:Yuki Doll, Hiroyuki Koga, Hirokazu Tsukaya
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.2026351118
環境変化に応じて遺伝子が空間配置を変化させ発現をONにする仕組みの解明
1大阪大学、2東京大学

シロイヌナズナにおいて核膜の裏打ち構造(核ラミナ)の構成タンパク質であるCRWNsが核膜直下でメッシュ状の局在パターンを示すことを超解像顕微鏡STEDを用いて明らかにした。また、環境変化に応じてCRWNsがクロマチンと結合しクロマチンの核内配置を制御することで、遺伝子発現を調節することを明らかにした。
詳しくは、プレスリリース大阪大学(2020年11月20日)『環境変化に応じて遺伝子が空間配置を変化させ発現をONにする仕組みの解明』をご覧ください。
【論文情報】
タイトル:Subnuclear gene positioning through lamina association affects copper tolerance
著者:Yuki Sakamoto, Mayuko Sato, Yoshikatsu Sato, Akihito Harada, Takamasa Suzuki, Chieko Goto, Kentaro Tamura, Kiminori Toyooka, Hiroshi Kimura, Yasuyuki Ohkawa, Ikuko Hara-Nishimura, Shingo Takagi, Sachihiro Matsunaga
雑誌名::Nature Communications
DOI: 10.1038/s41467-020-19621-z
ホールマウントin situで見えてきた無限成長葉の不思議な性質
東京大学

左:モノフィレアの一種であるMonophyllaea glabraの成熟した個体。手前の大きな葉が無限に成長し続ける子葉で、その最も基部から花序が立ち上がっている。
右:ホールマウントin situハイブリダイゼーションでAN3遺伝子のはたらく領域を青く染めた図。無限に成長し続ける子葉で、青く染まった部分がAN3のはたらく領域。黄色い線の内側がモノフィレアの茎頂分裂組織にあたる組織。モデル植物のシロイヌナズナではAN3は茎頂分裂組織ではたらかず、葉の分裂組織でのみはたらく。
詳しくは、プレスリリース東京大学(2020年8月12日)『無限成長する葉の不思議な性質を発見』をご覧ください。
【論文情報】
タイトル:Expression profiles of ANGUSTIFOLIA3 and SHOOT MERISTEMLESS, key genes for meristematic activity in a one-leaf plant Monophyllaea glabra, revealed by whole-mount in situ hybridization
著者:Ayaka Kinoshita, Hiroyuki Koga, Hirokazu Tsukaya
雑誌名:Frontiers in Plant Science
DOI: 10.3389/fpls.2020.01160
植物の形づくりを促すアミノ酸代謝を発見
基生研

コケ植物の一種であるヒメツリガネゴケは、平面的に成長する糸状の原糸体と、立体的に成長するシュート(茎葉体)を環境に応じて作り分ける。今回の研究から、アルギニン代謝は茎葉体の成長を促進する特別な機能をもつことが分かった。また、AN3/GIF1ファミリーがその過程に関わることも明らかになった。
詳しくは、プレスリリース自然科学研究機構 生命創成探究センター(2020年9月9日)『植物の形づくりを促すアミノ酸代謝を発見』をご覧ください。
【論文情報】
タイトル:Metabolic control of gametophore shoot formation through arginine in the moss Physcomitrium patens
著者:Kensuke Kawade, Gorou Horiguchi, Yuu Hirose, Akira Oikawa, Masami Yokota Hirai, Kazuki Saito, Tomomichi Fujita, Hirokazu Tsukaya
雑誌名:Cell Reports
DOI: 10.1016/j.celrep.2020.108127
シロイヌナズナ実生の接木を効率化する接木チップの開発
名古屋大学

シロイヌナズナ実生の接木(micrografting)を簡便に実施できる「接木チップ」を開発した。透明なシリコン樹脂で作られており、播種から接木後の培養までを、このチップ内で完結させることができる(図1)。野生株と変異体、過剰発現体などの組み合わせで接木を実施することで、長距離移動するシグナル分子の解析が可能である(図2)。
詳しくは、プレスリリース名古屋大学(2020年4月23日)『接木が誰でも簡単に!〜芽生えの接木を効率化する接木チップの開発〜』をご覧ください。
【論文情報】
タイトル:Micrografting device for testing systemic signaling in Arabidopsis
著者:Hiroki Tsutsui, Naoki Yanagisawa, Yaichi Kawakatsu, Shuka Ikematsu, Yu Sawai, Ryo Tabata, Hideyuki Arata, Tetsuya Higashiyama, Michitaka Notaguchi
雑誌名:The Plant Journal
DOI: 10.1111/tpj.14768
根の細胞壁構造カスパリー線を制御する分子機構を解明
ジュネーブ大学 理学部

シロイヌナズナの根の細胞壁構造。野生型(写真左上)では正常に形成されるが、sgn3変異体(左下)では間隙が生じて養分吸収が損なわれる。X線結晶構造解析を用いて、SGN3受容体タンパク質とそのリガンドであるCIF2ペプチドの複合体立体構造(右)を明らかにした。これを基盤とすることで、新規ペプチドと共受容体も同定した。
詳しくは、プレスリリース ジュネーヴ大学(2020年1月22日)『Molecular mechanism for the recognition of sequence-divergent CIF peptides by the plant receptor kinases GSO1/SGN3 and GSO2』・国立遺伝学研究所(2020年1月22日)『細胞外空間を制御するシグナルを開始する分子機構の構造的基盤』をご覧ください。
【論文情報】
タイトル:Molecular mechanism for the recognition of sequence-divergent CIF peptides by the plant receptor kinases GSO1/SGN3 and GSO2
著者:Satohiro Okuda, Satoshi Fujita, Andrea Moretti, Ulrich Hohmann, Verónica G. Doblas, Yan Ma, Alexandre Pfister, Benjamin Brandt, Niko Geldner, Michael Hothorn
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.1911553117
細胞の温度を見るための方法をマニュアル化することに成功
大阪府立大学 生命環境科学研究科

独自に開発した蛍光温度プローブ(写真左上)と、蛍光寿命イメージング顕微鏡(右下)を使用することにより、動物培養細胞の中の温度分布を可視化し計測する手法を開発し、その手法の詳細なマニュアルを発表しました。この手法により、動物培養細胞では細胞核の温度が細胞質よりも高いことが明らかになっています。
詳しくは、プレスリリース 大阪府立大学(2019年3月27日)『細胞の温度を見るための方法をマニュアル化に成功! ―病態細胞の研究に貢献―』をご覧ください。
【論文情報】
タイトル:Temperature imaging using a cationic linear fluorescent polymeric thermometer and fluorescence lifetime imaging microscopy
著者:Noriko Inada, Nanaho Fukuda, Teruyuki Hayashi, Seiichi Uchiyama
雑誌名:Nature protocols
DOI: 10.1038/s41596-019-0145-7
真核生物の起源につながる、細胞内小器官の分裂を制御するメカニズムを発見
東京理科大学 理工学部 応用生物科学科

ミトコンドリアを1個しか持たないCyanidioschyzon merolaeを用いて、細胞分裂キナーゼAurora kinaseがミトコンドリア分裂にも関与することを発見した。シゾンのAurora kinaseは、ミトコンドリア分裂制御因子CmDnm1を直接リン酸化する。リン酸化ミミックにしたCmDnm1タンパク質を細胞内で強発現させると、ミトコンドリア分裂に異常が生じ、片方の娘細胞にしかミトコンドリアが分配されない。
詳しくは、プレスリリース 東京理科大学(2019年12月20日)『真核生物の起源につながる、細胞内小器官の分裂を制御するメカニズムを発見
~「自分の中のよそもの」との同時増殖を可能にした制御機構とは?~』をご覧ください。
【論文情報】
タイトル:Cyanidioschyzon merolae aurora kinase phosphorylates evolutionarily conserved sites on its target to regulate mitochondrial division
著者:Shoichi Kato, Erika Okamura, Tomoko M. Matsunaga, Minami Nakayama, Yuki Kawanishi, Takako Ichinose, Atsuko H. Iwane, Takuya Sakamoto, Yuuta Imoto, Mio Ohnuma, Yuko Nomura, Hirofumi Nakagami, Haruko Kuroiwa, Tsuneyoshi Kuroiwa, Sachihiro Matsunaga
雑誌名:Communications Biology
DOI: 10.1038/s42003-019-0714-x
アオミドロの性を実験的に誘導して13種の同定に成功
1神戸大学・理、2東京大学・理

アオミドロ属13種の培養株の栄養細胞(a)、接合胞子及び不動胞子(b, c)。アオミドロでは培養株の接合誘導が困難であったため、これまで野外で有性生殖を行っている個体を採集して種を同定する必要があった。本研究では独自に改良した寒天プレートによる有性生殖誘導によって、13種の培養株の正確な種同定に成功した。
詳しくは、プレスリリース 東京大学(2019年5月23日)『アオミドロの性を実験的に誘導して13種の同定に成功』、プレスリリース紹介ビデオ(2019年7月24日)『アオミドロを性誘導して種を見分ける』をご覧ください。
【論文情報】
タイトル:Identification of 13 Spirogyra species (Zygnemataceae) by traits of sexual reproduction induced under laboratory culture conditions
著者:Tomoyuki Takano, Sumio Higuchi, Hisato Ikegaya, Ryo Matsuzaki, Masanobu Kawachi, Fumio Takahashi, Hisayoshi Nozaki
雑誌名:Scientific Reports
DOI: 10.1038/s41598-019-43454-6
植物の根におけるホウ素過剰耐性メカニズムの一端を解明
東京理科大学理工学部

シロイヌナズナのプロテアソーム変異体rpt5aでは、栄養元素の一つであるホウ素が過剰に存在する条件において、クロマチンリモデリング因子BRMの機能抑制により根端分裂組織の形態異常が緩和される(上図rpt5a brm二重変異株)。このことから、RPT5aはホウ素過剰条件においてBRMを適切に分解することで、適切な根端形態を維持していることが明らかとなった。矢印は根端分裂組織の大きさを示す。
詳しくは、プレスリリース 東京理科大学(2018年12月12日)、『植物におけるホウ素毒性メカニズムの一端を解明 ~過剰なホウ素がもたらすDNA 損傷の発生とその緩和機構の発見~』をご覧ください。
【論文情報】
タイトル:Proteasomal degradation of BRAHMA promotes Boron tolerance in Arabidopsis
著者:Takuya Sakamoto, Yayoi Tsujimoto-Inui, Naoyuki Sotta, Takeshi Hirakawa, Tomoko M. Matsunaga, Yoichiro Fukao, Sachihiro Matsunaga, Toru Fujiwara
雑誌名:Nature Communications
DOI: 10.1038/s41467-018-07393-6
植物の受精卵が極性化する過程での液胞の動態を解明
名古屋大学

シロイヌナズナの受精卵における核と液胞の同時観察像。野生型(左)では、核が頂端側(将来の植物体の地上部側)に移動する一方で、液胞は核の周囲に管状構造を作り、基部側(地下部側)に蓄積する。液胞が管状構造を作れないsgr2変異体(右)では、液胞は基部側へ移行できず、核の移動を阻害するため、受精卵の非対称分裂が損なわれる。
詳しくは、プレスリリース 名古屋大学トランスフォーマティブ生命分子研究所(ITbM)(2019年1月21日)、『世界初!植物の受精卵が非対称に分裂する仕組みを発見』をご覧ください。
【論文情報】
タイトル:Polar vacuolar distribution is essential for accurate asymmetric division of Arabidopsis zygotes
著者:Yusuke Kimata, Takehide Kato, Takumi Higaki, Daisuke Kurihara, Tomomi Yamada, Shoji Segami, Miyo Terao Morita, Masayoshi Maeshima, Seiichiro Hasezawa, Tetsuya Higashiyama, Masao Tasaka, Minako Ueda
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.1814160116
花粉管を長く伸ばすために必要な膜交通のしくみを発見
基礎生物学研究所 細胞動態研究部門

シロイヌナズナのpicalm5a picalm5b二重変異体では、花粉管の先端が伸長の途中で破裂する。この花粉管では、花粉管先端に局在し破裂を抑制するレセプター様キナーゼであるANXURが、広範囲の細胞膜に拡散してしまう(上図)。このことから、PICALM5aとPICALM5b がANXURを花粉管先端へ局在させるために必要であることが明らかになった。
詳しくは、プレスリリース 基礎生物学研究所(2018年10月1日)、『花粉管を長く伸ばすために必要な膜交通のしくみを発見』をご覧ください。
【論文情報】
タイトル:ANTH domain-containing proteins are required for the pollen tube plasma membrane integrity via recycling ANXUR kinases
著者:Keita Muro, Kumi Matsuura-Tokita, Ryoko Tsukamoto, Masahiro M. Kanaoka, Kazuo Ebine, Tetsuya Higashiyama, Akihiko Nakano, Takashi Ueda
雑誌名:Communications Biology
DOI: 10.1038/s42003-018-0158-8
植物細胞の大きさを決めるサイコロゲームを発見
1岡崎統合バイオ、2基生研、3東大・院・理

シロイヌナズナの葉の表皮細胞(左)と柵状組織の細胞(右)の図 。細胞の大きさに合わせて黄色(小さい)から赤色(大きい)に色づけしている。ジグソーパズルのような形をした表皮細胞の大きさはバラバラだが、丸い柵状組織の細胞は大きさが揃っている。スケールバーは100
µm。表皮細胞の大きさがバラバラなのは、サイコロゲームのように無作為に核内倍加が起こり、それに応じて一定割合で細胞の肥大促進が起こるからである。
詳しくは、プレスリリース 基礎生物学研究所(2017年9月20日)、東京大学大学院理学系研究科(2017年9月20日)、『植物細胞の大きさを決めるサイコロゲーム 』をご覧ください。
【論文情報】
タイトル:Probing the stochastic property of endoreduplication in cell size determination of Arabidopsis thaliana leaf epidermal tissue
著者:Kensuke Kawade, Hirokazu Tsukaya
雑誌名:PLOS ONE
DOI: 10.1371/journal.pone.0185050
シンプルな物理現象「拡散」で葉の形や大きさが決まる仕組みを解明
1岡崎統合バイオ、2基生研、3東大・院・理

シロイヌナズナの葉原基におけるANGUSTIFOLIA3(AN3)タンパク質の空間分布。AN3のmRNAは葉原基の葉身基部で限定的に発現するが、その翻訳産物のAN3タンパク質は、そこから単純拡散で先端=基部軸に沿って濃度勾配を作る。この拡散は細胞の密度に影響されるため、大きな細胞からなり密度の低い葉原基先端部では、拡散速度がたかまる。このことにより、AN3タンパク質の特徴的な勾配が形成される。この濃度勾配は、葉原基における細胞分裂の空間頻度分布に読み替えられている。
詳しくは、プレスリリース(2017年9月6日)、『シンプルな物理現象「拡散」で葉の形や大きさが決まる仕組みを解明 』をご覧ください。
【論文情報】
タイトル:Spatially different tissue-scale diffusivity shapes ANGUSTIFOlIA3 gradient in growing leaves
著者:Kensuke Kawade, Hirokazu Tanimoto, Gorou Horiguchi, Hirokazu Tsukaya
雑誌名:Biophysical Journal
DOI: 10.1016/j.bpj.2017.06.072
Hollidayジャンクション解離酵素は葉緑体核様体の均等分配に必須である
1京大・院・理、2遺伝研、3山口大・院・創成科学

葉緑体核様体は葉緑体DNA分配の基盤である。野生型では、葉緑体核様体は葉緑体分裂の際に積極的に分散し均等分配される。しかし、monokaryotic chloroplast (moc)1変異体では葉緑体核様体が凝集し、不均等分配が起こる(上図)。moc1変異体で壊れていたのは、葉緑体DNAを正確に切断するHolliday junciton解離酵素であった
詳しくは、プレスリリース(2017年5月15日)、『葉緑体増殖の基礎的しくみを解明 -葉緑体分裂・増殖時にDNA分配を制御する酵素の発見-』をご覧ください。
【論文情報】
タイトル:Holliday junction resolvases mediate chloroplast nucleoid segregation
著者:Yusuke Kobayashi, Osami Misumi, Masaki Odahara, Kota Ishibashi, Masafumi Hirono, Kumi Hidaka, Masayuki Endo, Hiroshi Sugiyama, Hiroshi Iwasaki, Tsuneyoshi Kuroiwa, Toshiharu Shikanai, Yoshiki Nishimura
雑誌名:Science
DOI: 10.1126/science.aan0038
植物の根が水を求めて伸びるために必須な細胞を発見
山形大・理学部

根の皮層細胞のみでMIZ1遺伝子を発現するmiz1突然変異体。miz1突然変異体は水分屈性を欠損しています。野生型MIZ1を皮層細胞で発現させる(緑色蛍光)と変異体の表現型が相補されることから、皮層細胞がMIZ1のはたらく細胞として水分屈性に必須であることがわかりました。赤色の蛍光は、根の細胞の輪郭を示しています。
詳しくは、プレスリリース 東北大(2017年5月10日)、『植物の根が水を求めて伸びるしくみを発見-乾燥地で生きるために働く細胞群-』、プレリリース 山形大(2017年5月18日)、『植物の根が水を求めて伸びるために必須な細胞を発見』をご覧ください。
【論文情報】
タイトル:Root hydrotropism is controlled via a cortex-specific growth mechanism
著者:Daniela Dietrich, Lei Pang, Akie Kobayashi, John A. Fozard, Véronique Boudolf, Rahul Bhosale, Regina Antoni, Tuan Nguyen, Sotaro Hiratsuka, Nobuharu Fujii, Yutaka Miyazawa, Tae-Woong Bae, Darren M. Wells, Markus R. Owen, Leah R. Band, Rosemary J. Dyson, Oliver E. Jensen, John R. King, Saoirse R. Tracy, Craig J. Sturrock, Sacha J. Mooney, Jeremy A. Roberts, Rishikesh P. Bhalerao, José R. Dinneny, Pedro L. Rodriguez, Akira Nagatani, Yoichiroh Hosokawa, Tobias I. Baskin, Tony P. Pridmore, Lieven De Veylder, Hideyuki Takahashi, Malcolm J. Bennett
雑誌名:Nature Plants
DOI: 10.1038/nplants.2017.57
細胞内共生による葉緑体誕生に必須であった細胞と葉緑体の分裂同調化機構の解明
1遺伝研・細胞遺伝・共生細胞進化、2JST・CREST、3慶應大・生物、4総研大・遺伝学

葉緑体分裂タンパク質DRP5Bのドミナントネガティブ変異型を発現誘導して24時間後の単細胞紅藻Cyanidioschyzon merolae。葉緑体分裂開始後にDRP5Bのドミナントネガティブ変異型の発現誘導により葉緑体分裂を阻害すると、細胞周期は葉緑体が分裂していないのにも関わらず進行する。この結果、核を2個、葉緑体を1個もつ細胞が生じる。
詳しくは、プレスリリース(2016年11月15日)、『細胞内共生による葉緑体誕生に必須であった細胞と葉緑体の分裂同調化機構の解明』をご覧ください。
【論文情報】
タイトル:Chloroplast division checkpoint in eukaryotic algae
著者:Nobuko Sumiya, Takayuki Fujiwara, Atsuko Era, Shin-ya Miyagishima
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI: 10.1073/pnas.1612872113
可視化されたヒメツリガネゴケの葉緑体を覆うペプチドグリカン「壁」
熊本大・院・先端科学

緑色植物の光合成の場である葉緑体は二重の包膜のみで囲まれていると考えられてきました。しかし、今回、高感度なペプチドグリカン検出システムを使い、今まで電子顕微鏡でも観察できなかった、コケ植物の葉緑体を覆うペプチドグリカン「壁」を可視化することに成功しました。
詳しくは、プレスリリース(2016年6月21日)、『コケ植物の葉緑体に「壁」を発見』をご覧ください。
【論文情報】
タイトル:Moss Chloroplasts are Surrounded by a Peptidoglycan Wall Containing D-Amino Acids
著者:Takayuki Hirano, Koji Tanidokoro, Yasuhiro Shimizu, Yutaka Kawarabayasi, Toshihisa Ohshima, Momo Sato, Shinji Tadano, Hayato Ishikawa, Susumu Takio, Katsuaki Takechi, Hiroyoshi Takano
雑誌名:The Plant Cell
DOI: 10.1105/tpc.16.00104
クロレラのリン蓄積動態を解明
1東大・院・新領域、2国立環境研、3東大・FC推進機構

クロレラをはじめとする微細藻類は、細胞内にリンを蓄積することが知られていましたが、細胞内の蓄積動態については詳しくわかっていませんでした。本研究は、生理生化学的方法と元素イメージング法のひとつであるエネルギー分散型X線分析法により、これまで単に高電子密度顆粒と呼ばれ機能未知だった部分に、ポリリン酸としてリンが蓄積していることを明らかにしました。
詳しくは、プレスリリース(2016年5月16日)、『リンを高蓄積するクロレラ―地上から失われつつあるリンの水中での回収に期待―』をご覧ください。
【論文情報】
タイトル:Deciphering the relationship among phosphate dynamics, electron-dense body and lipid accumulation in the green alga Parachlorella kessleri
著者:Shuhei Ota, Mai Yoshihara, Tomokazu Yamazaki, Tsuyoshi Takeshita, Aiko Hirata, Mami Konomi, Kenshiro Oshima, Masahira Hattori, Kateřina Bišová, Vilém Zachleder, Shigeyuki Kawano
雑誌名:Scientific Reports
DOI: 10.1038/srep25731
植物Y染色体遺伝子地図を作成
1理化学研究所、2東大・院・新領域、3東大・FC推進機構

ナデシコ科のヒロハノマンテマはXY染色体をもつ雌雄異株植物で雄花(オス♂)と雌花(メス♀)を別々の株につけます。このオス株のY染色体に重イオンビームでランダムに欠失変異を導入し、「両性花」変異体や「無性花」変異体を得ました(図参照)。変異体の欠失をスパコンで整列しY染色体の地図を作りました。この地図をX染色体地図と比べたところ、進化の過程でY染色体の向きが逆転していることを発見しました。
詳しくは、プレスリリース 東大・院・新領域(2016年1月8日)、理化学研究所(2016年1月8日)『植物Y染色体遺伝子地図を作成―重イオンビームで作った変異体を使用、進化の過程でY染色体は逆位を起こしていた― 』をご覧ください。
【論文情報】
タイトル:A new physical mapping approach refines the sex-determining gene positions on the Silene latifolia Y-chromosome
著者:Yusuke Kazama, Kotaro Ishii, Wataru Aonuma, Tokihiro Ikeda, Hiroki Kawamoto, Ayako Koizumi, Dmitry A.Filatov, Margarita Chibalina, Roberta Bergero, Deborah Charlesworth, Tomoko Abe, Shigeyuki Kawano
雑誌名:Scientific Reports
DOI: 10.1038/srep18917
植物を丸ごと透明化し、中まで観察する新技術を開発
〜解剖することなく、植物の内部を細胞レベルで蛍光観察〜
1名大・院・理、2名大・ITbM、3JST・さきがけ

植物透明化試薬ClearSeeにより透明化したシロイヌナズナめしべを丸ごと蛍光観察した。花粉管を4色の蛍光タンパク質(mTFP1、sGFP、Venus、mApple)で標識している。今回、蛍光タンパク質の活性を保持したまま、植物の蛍光観察の妨げになるクロロフィルを取り除き、透明化する試薬ClearSee(クリアシー)の開発に成功した。
詳しくは、プレスリリース (2015年10月28日)、『植物を丸ごと透明化し、中まで観察する新技術を開発 〜解剖することなく、
植物の内部を細胞レベルで蛍光観察〜』をご覧ください。
【論文情報】
タイトル:ClearSee: a rapid optical clearing reagent for whole-plant fluorescence imaging
著者:Daisuke Kurihara, Yoko Mizuta, Yoshikatsu Sato, Tetsuya Higashiyama
雑誌名:Development
DOI: 10.1242/dev.127613
バナースペース
日本植物形態学会
学会事務局
〒860-8555
熊本県熊本市中央区黒髪2-39-1
熊本大学理学部内 日本植物形態学会(庶務幹事:武智克彰)
ktakechi@kumamoto-u.ac.jp
(@は半角に直してください)
日本植物形態学会ウェブサイト担当
〒525-8577
滋賀県草津市野路東1-1-1
立命館大学 日本植物形態学会(広報委員長:元村一基)
kazuki-m@ritsumei.ac.jp
(@は半角に直してください)
