研究代表者:松井 広(東北大学大学院 医学系研究科 新医学領域創生分野 准教授)
連携研究者:田中 謙二(慶應義塾大学・特任准教授・遺伝子改変動物作製)
山中 章弘(名古屋大学・教授・神経化学・ウィルスの作製)
深澤 有吾(福井大学・教授・組織化学/微細形態電顕解析)
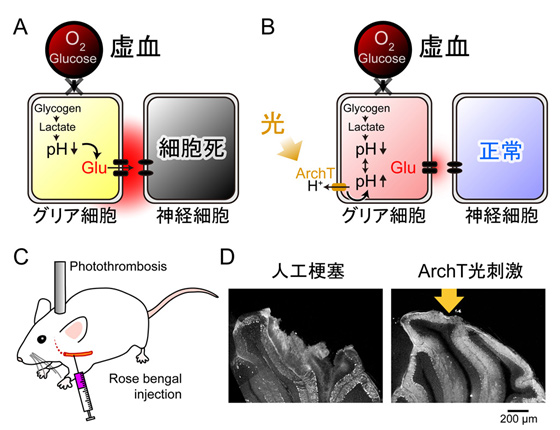
脳細胞の半数を占めるグリア細胞も神経細胞と同様に、様々な信号を担っており、近年、神経とグリア細胞の間に双方向性の信号伝達が存在することも明らかになった。グリア細胞におけるCa2+やH+といった細胞内イオンの変動が、最終的には意識の状態にも影響を与えている可能性もある。しかし、こういった神経とグリアの織り成すネットワーク間の相互作用は、通常の状態では他の作用に埋もれて見出すのは容易ではない。そこで、本研究では、虚血といった極端な環境におかれた脳の研究を通して、グリアの働きを最大限に引き出す。脳虚血時においては、細胞内アシドーシスやグルタミン酸過剰放出による興奮性神経毒性が生じる。これまで、細胞死へと至る発端となるグルタミン酸の放出を止める手立ては考えられておらず、そもそもどの細胞が主要な放出源であるのかすら特定されていない。本研究では、脳虚血時にグルタミン酸が放出されるメカニズムを明らかにし、細胞内イオン濃度を光操作することで放出そのものを止め、虚血性脳障害を回避させる方法を編み出すことを目指す。このグリアの作用が、健常時において、どれだけ機能しているかを明らかにする試みにもつなげたい。
研究代表者:小山 隆太(東京大学大学院 薬学系研究科 薬品作用学教室 准教授)
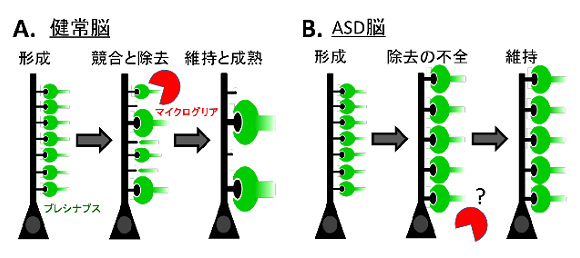
神経発達障害へのマイクログリアの関与についての知見は十分でない。本研究では、自閉症スペクトラム(autism spectrum disorders: ASD)における神経回路変性の一因とされるシナプス除去の不全に、マイクログリアが積極的に関与する可能性を検証する。なお、マイクログリアは相対的に神経活動の弱いシナプスを貪食することが示唆されているため、神経活動の関与にも着目する。本研究では、特に海馬神経回路に着目して以下の2点に集中する。①研究代表者らはすでにASDモデルマウスの海馬CA3野におけるシナプスの過剰形成を発見している。そこで、正常脳ではマイクログリアが積極的に不要なシナプスの除去をおこなうが、ASD脳ではマイクログリアの不活性化がおこり、これがシナプス除去の不全につながる可能性を検証する。②マイクログリアによる苔状線維シナプス除去に神経活動が関与することをDREADDシステム等を用いてin vitroおよびin vivo実験系で解明する。また、ASD海馬に存在するマイクログリアを脳由来神経栄養因子(BDNF)により再活性化させてシナプス除去能力を回復させることを試みる。
研究代表者:池内 健(新潟大学 脳研究所 遺伝子機能解析学 教授)
連携研究者:他田真理(新潟大学脳研究所病理学)
他田正義(新潟大学脳研究所神経内科)
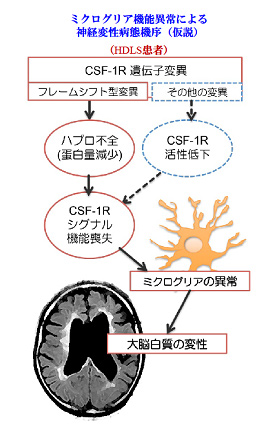
ミクログリアの異常が様々な神経疾患の病態に関与していることは多くの研究者が認めることであるが,疾患病態の本態にどの程度関与しているかについては明確ではない。神経細胞の障害に伴って反応性にミクログリアの活性化が生じ,疾患の病態を修飾するという観点からの研究が主に従来までは進められてきたように思う。最近になり,ミクログリアそのものの機能異常が神経変性疾患の原因となる「一次性ミクログリア病」という概念が注目されている。一次性ミクログリア病の例として,colony stimulating factor-1 receptor (CSF-1R) 遺伝子変異を原因とする神経軸索スフェロイドを伴うびまん性白質脳症(HDLS: hereditary diffuse leukoencephalopathy with spheroids)がある。HDLSの病変の主座は大脳白質であり,病理学的にスフェロイド形成を伴う神経軸索の脱落とオリゴデンドログリアの脱髄を特徴とする。私たちは現在までHDLSについて解析を行い,培養細胞を用いた研究により,変異関連CSF-1Rではリガンド依存性のシグナル伝達が障害されていること,HDLS患者脳ではミクログリアの数が減少し形態異常を呈することを見出している。今後,ミクログリアの一次的な機能異常がメインストリートなるHDLSの病態機序の解明を本研究で展開したい。
研究代表者:宝田 剛志(金沢大学大学院 医薬保健学総合研究科 薬物学 助教)
連携研究者:檜井 栄一(金沢大学医薬保健研究域薬学系・准教授)
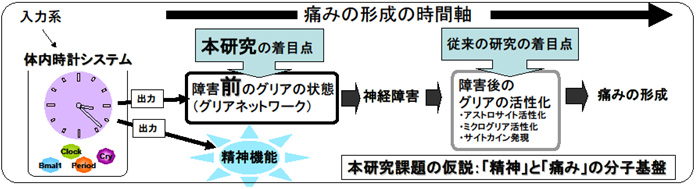
グリア病である神経障害性疼痛では、精神疾患や精神的ストレスとの関連性が指摘されている。また、精神疾患と疼痛との関連性も臨床上指摘されている(うつを伴う慢性痛、統合失調症の痛覚鈍麻など)。しかし、この「精神と疼痛(痛み)」の関連性(連関)の分子基盤は未解明である。我々の解析結果より、睡眠障害等の精神疾患との関連性が深い体内時計システムが破綻したマウスでは、脳・脊髄組織でのアストロサイトの異常な活性化が認められた。同マウスにて行動学的解析を実施した結果、多動といった精神行動異常が観察されただけでなく、神経障害性疼痛モデルを実施した結果、障害時における疼痛(アロディニア)に異常が認められた。これら解析結果より、従来の疼痛研究の対象を変えて障害前のグリアに注目することで、「グリアネットワークの破綻」を、単一個々の精神神経疾患ではなく、「精神と痛み」連関メカニズムにおける共通の中間表現型として捉えることができる。本研究では、「体内時計によるグリアネットワークの制御」という観点から、「精神と痛み」連関の分子メカニズムを明らかとする。
研究代表者:今井 啓雄(京都大学霊長類研究所)
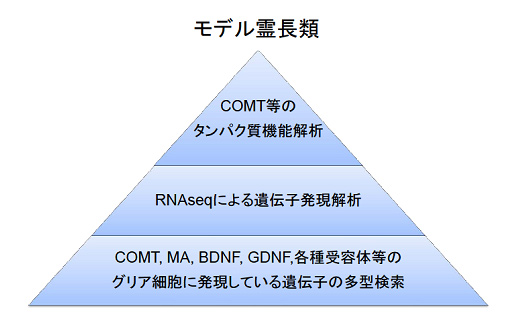
ニホンザル・マーモセットなどの非ヒト霊長類をモデルとしたグリアネットワークの研究基盤を構築する。ヒトではMRI等の非侵襲的な実験しかできないため、分子・細胞レベルでの研究は困難である。一方で、マウスではトランスジェニック、ノックイン・ノックアウトなどの遺伝子工学が多用できるが、脳機能が発達したヒトのグリアネットワークを知るためには不十分な点も多い。本研究計画では、(1)サル個体からのグリア細胞分離とRNAseq、(2)COMT, MA, BDNF, GDNF,各種受容体等のグリア細胞に発現している遺伝子の多型検索、(3)遺伝子多型がもたらすタンパク質表現型の生化学的解析を通じて、分子エビデンスに基づくモデルサルの探索を行う。また、これらの結果に基づき、当該個体(群)の繁殖を行うとともに、遺伝子導入についても検討する。申請者らはこれまでCOMT等の多型解析と生化学的機能解析、味覚受容体の多型解析と行動実験等により、遺伝子変異サルの発見と繁殖を行ってきた。特に、マーモセットでは盲腸に味覚受容体とGタンパク質・チャネルが発現していることを発見したため、脳腸相関にかかわると考えられる腸管グリアの役割についても検討したい。
研究代表者:安井 正人(慶應義塾大学・医学部・教授)
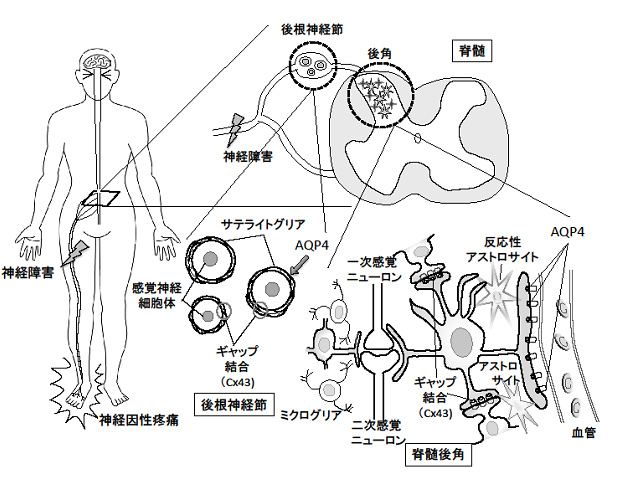
神経因性疼痛は糖尿病、自己免疫疾患、手術後など様々な病態に伴う神経損傷で引き起こる慢性疼痛である。疼痛慢性化の機序として、神経障害を受けたレベルの脊髄後角および後根神経節でグリア細胞が異常に増殖し活性化していることがわかり、グリアアセンブリの破綻の寄与が注目されている。グリア細胞、アストロサイトに発現するアクアポリン4(AQP4)は、脳疾患の様々な病態(脳浮腫、痙攣、視神経脊髄炎(NMO)等)に関与する他、嗅覚や聴覚障害との関連も明らかとなった。また、AQP4とギャップ結合を介した細胞外カリウムのサイフォニングとの関連も示唆されている。最近、我々は後根神経節のサテライトグリアにおいても中枢神経アストロサイトと同様、AQP4が発現していることを確認した。そこで、本研究では神経因性疼痛の病態におけるAQP4の役割をグリアアセンブリの破綻との関連で理解することを目的としている。マウス坐骨神経部分切断モデルを用いて、1)免疫組織学的解析、2)脊髄レベルにおける神経細胞/グリア細胞の機能解析、3)マウス行動解析を行い、神経因性疼痛の病態の解明に迫る。
研究代表者:北爪 しのぶ(理研・疾患糖鎖研究チーム・副チームリーダー)
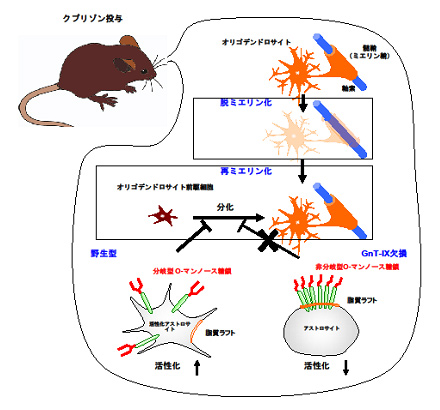
脳特異的な糖鎖の存在が明らかになってきたものの、その機能については不明の点が多い。O-マンノース糖鎖はジストログリカン上に存在し、この糖鎖不全が原因で起きる筋ジストロフィーの存在が明らかになってきたが、分岐型O-マンノース糖鎖は脳に特異的に受容体タンパク質チロシンホスファターゼβ(RPTPβ)に結合する。分岐型O-マンノース糖鎖が欠損したマウス(GnT-IX KOマウス)では、脱髄疾患の際に再ミエリン化が亢進していることが最近分かってきた。この背景として、アストロサイトの活性化が抑制していることも判明した。本研究では、分岐型O-マンノース糖鎖がアストロサイト上のRPTPβの活性化を調節することで、下流のどのようなシグナル分子が影響を受け、細胞の活性化が調節されるのか明らかにすると共に、アストロサイトとオリゴデンドロサイトのクロストークの実体を明らかにすることを目指す。具体的には野生型およびGnT-IX KOマウスを用いて下記の実験を遂行する。
(1) アストロサイトのプロテオーム解析
(2) 脱髄モデルマウスの詳細な時系列解析
研究代表者:山内淳司(国立成育医療研究センター研究所・薬剤治療研究部・分子薬理研究室)
連携研究者:宮本 幸(国立成育医療研究センター研究所・薬剤治療研究部・分子薬理研究室)
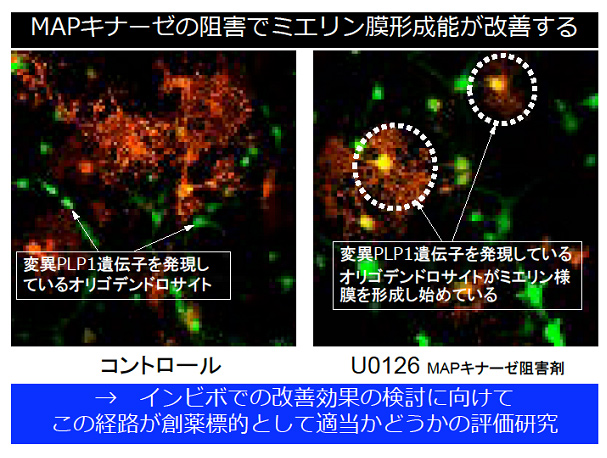
神経軸索の電気伝導効率を増加させる髄鞘(ミエリン)は、神経の軸索の周りを囲む複層膜構造体である。ミエリン膜はグリア細胞の膜に由来し、完成したミエリン膜の表面積は分化前のそれと比較して百倍以上になることもある。脳や脊髄などの中枢神経ではオリゴデンドロサイトがミエリン膜をつくるが、その過程に異常がおき、ミエリン膜形成不全に陥ると、最終的には神経細胞にも変性を生じさせる重篤な疾病が引き起こされる。そのなかにペリチェウス・メルツバッハ病(PMD)がある。PMDは遺伝的変異が原因でおこる唯一の中枢神経脱ミエリン病として知られ、国内では約100家族いることが判明している。しかし、その特異的治療薬は無い。研究代表者らは、最近、池中一裕教授から譲渡されたPMDモデルマウスを用い、MAPキナーゼが脊髄の病態組織で非常に強く活性化されることを明らかにした。現在、遺伝子改変技術を用い、個体内でMAPキナーゼ経路をシャットダウンすると、PMDの症状が改善するかどうか検討している。具体的には、各組織および神経機能レベルでの改善を検討し、MAPキナーゼ経路に属する分子群が創薬標的候補分子であることを証明したい。
研究代表者:池田匡志(藤田保健衛生大学・医学部・精神神経科学)
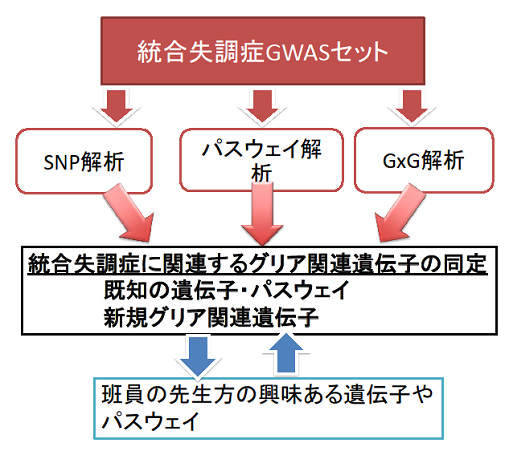
本研究では、網羅的解析である全ゲノム関連研究(GWAS)を基盤としたデータセットを駆使し、膨大な擬陰性を示す一塩基多型(SNP)の中から、「グリア」というキーワードを用いることで、グリア(関連)遺伝子のSNPと統合失調症(SCZ)の関連性について再評価を行うことにある。一般的に行われているSNP関連解析に加え、グリア関連の既知のパスウェイ情報を用いたパスウェイ解析、及び遺伝子—遺伝子(GxG)相互作用解析を行う。
3個のGWASデータセットを用いる予定としており、本解析を通して統合失調症におけるグリア関連遺伝子の遺伝統計学的優先順位の指針を与えること、ひいては、新規のグリア関連「候補遺伝子」を選出することを目標とする。また、コラボレーターの興味ある遺伝子についてsharingを行うことで、双方向的な共同研究を推進していきたい。