研究代表者:柴崎 貢志(群馬大学大学院 医学系研究科 分子細胞生物学)
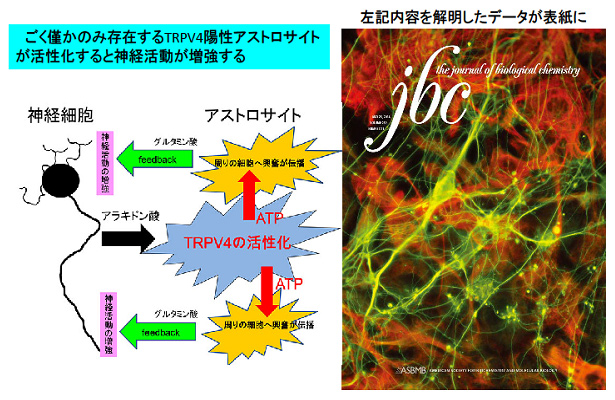
我々は温度感受性TRPチャネルに属するTRPV4(活性化温度閾値: 34℃以上)が海馬に高発現しており、脳内温度を介して海馬神経細胞の興奮性を向上させていることを見いだしている (J. Neurosci 2007)。脳組織標本を詳しく解析したところ、神経細胞の他、アストロサイトにもTRPV4発現を認めた。非常に興味深いことに、アストロサイトの中に、TRPV4陽性と陰性の二種類の細胞が存在しており、TRPV4陽性アストロサイトは約20%程度のマイナーなサブタイプを構成していた。さらに、TRPV4陽性アストロサイトはTRPV4の活性化に伴い、グリオトランスミッターを遊離し、周りのアストロサイトに興奮を伝播していることを突き止めた(JBC 2014)。このようなアストロサイトからの情報伝達物質の遊離は、アストロサイトTRPV4の活性化 → 周囲のアストロサイトの興奮 → 神経細胞の興奮というカスケードが存在する可能性を強く示唆しており、神経-グリアの機能連関・グリアアセンブリを調べるのにTRPV4が非常に有用なツールであることを強く示唆している。
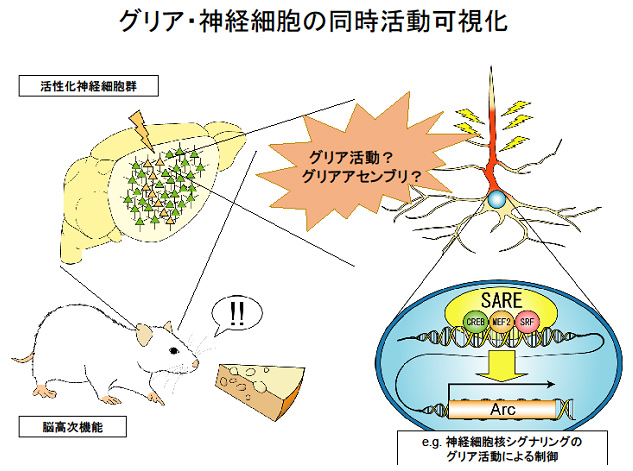
研究代表者:尾藤 晴彦(東京大学大学院医学系研究科 神経生化学分野)
グリア活動が神経活動・スパイン活動とどのように相関しているかを定量的に同時計測することには多くの困難が伴う。本研究では、これまで研究代表者が培ってきた神経細胞における多様なカルシウムシグナリング解析のノウハウ(Takemoto-Kimura et al. Neuron 2007; Okuno et al. Cell 2012)や、dual FRET imaging技術(Fujii et al. Cell Reports 2013)に基づき、神経細胞とグリア細胞のカルシウム同時測定をシステマティックに実現するための基盤技術開発を行う。本研究により、神経可塑性誘導・発現中に樹状突起内局所で引き起こされる生化学的・酵素学的プロセスのダイナミクスが、グリアにおけるシグナルダイナミクスとどのような関係にあるのかをin vivo で解明する端緒となることが期待される。
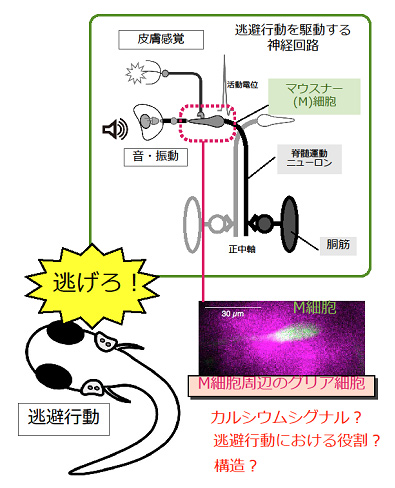
研究代表者:坂内 博子(名古屋大学大学院 理学研究科 生命理学専攻)
グリア細胞はほ乳類の脳において、カルシウムシグナル依存的にシナプス伝達や脳血流を制御する重要な役割を持つ。グリア細胞の存在は多くの生物種で知られているが、ほ乳類以外の動物において成熟した神経系で脳機能の制御に関わるか否かは明らかにされていない。本研究では、逃避行動を駆動する神経回路網が良く解明されているゼブラフィッシュをモデル動物として、魚類でもグリア細胞がカルシウムシグナル依存的に神経伝達を制御できるかを検討し、グリア細胞の進化的意義を探ることを目的とする.ゼブラフィッシュの逃避行動を司るマウスナー細胞(M細胞)周囲のグリア細胞にカルシウムセンサーを導入し、逃避行動に伴いカルシウムシグナルがグリア細胞で発生するかどうかを調べる。また魚類グリア細胞カルシウムシグナルの発生機序を明らかにする。さらに、グリア細胞の特異的な破壊やカルシウムシグナルの阻害が、M細胞へのシナプス伝達、シナプス可塑性、ゼブラフィッシュの逃避行動に与える影響を明らかにする。光学顕微鏡の分解能を越えた「超解像STED顕微鏡」を利用して、魚類にもほ乳類同様3者間シナプスと呼べる構造があるか否かも検討する。
研究代表者:匂坂 敏朗(神戸大学大学院 医学研究科 生理学 細胞生物学講座 教授)
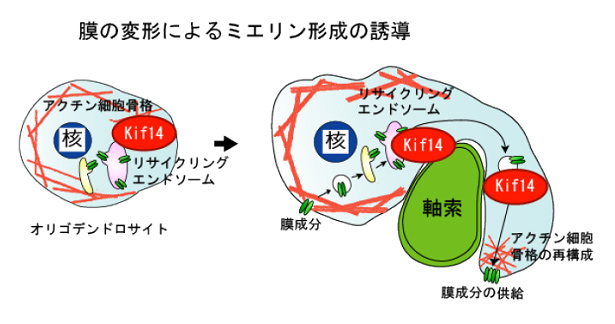
中枢神経のミエリン鞘はオリゴデンドロサイトが神経軸索上でダイナミックに運動、形態変化し、幾重にも軸索に巻きつくことで形成される。ミエリン鞘の多重層の形成には、細胞形質膜への多量の膜の供給と時期に応じた膜変形が必要であり、極めて高度な膜制御機構があるとされている(図を参照)。これまで報告されている末梢神経ミエリン鞘形成の培養系でも、多重層形成は再現出来ていない。全く偶然であるが、私の飼育するマウスコロニーの中に自然発症の運動失調ミュータントマウスを見出した。中枢神経ミエリン鞘の低形成があり、ミエリン鞘形成の初期段階であるオリゴデンドロサイトの突起進展に異常があった。遺伝子連鎖解析を行い、Kif14モータータンパク質が原因遺伝子であることを明らかにした。本研究では、膜進展方向への膜成分の供給、細胞骨格再編を介した膜変形、この二つの機能的な連動におけるKif14の役割を解析し、オリゴデンドロサイトのミエリン鞘形成過程の分子機構を解明する。
研究代表者:日浅 未来(岡山大学大学院医歯薬学総合研究科・WTT助教)
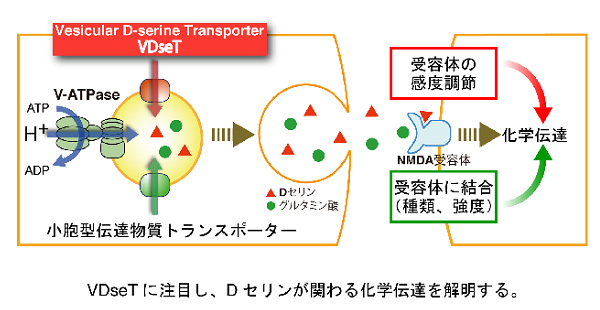
アストロサイトから分泌されるグリオトランスミッターは、グリア-グリア間、グリア-神経間にて積極的に情報伝達を行っている。小胞型伝達物質トランスポーターは開口放出に必須の分子であるが、アストロサイトの小胞や小胞型伝達物質トランスポーターの局在については不明な点が多い。研究代表者は、グリオトランスミッターのひとつであるDセリンに注目し、新たに小胞型Dセリントランスポーター(VDseT)を見いだした。本研究ではVDseTをプローブとすることで、Dセリンがアストロサイトのどの小胞に局在しているのか、どのような刺激でDセリンを分泌するのか解明する。DセリンはCo-agonistとしてグルタミン酸NMDA受容体に結合し、その機能を調整する、いわば感度調節型の伝達物質であるという点で重要である。そこでVDseTとその他ATPやグルタミン酸の小胞型トランスポーター等との機能連関を解析し、VDseTやDセリンがグリア機能に及ぼす影響解明を目指す。
研究代表者:掛川 渉 (慶應義塾大学・講師・神経生理学・電気生理学・行動学実験の遂行と統括)
連携研究者:柚﨑 通介 (慶應義塾大学・教授・神経生理学・本研究への助言)
三浦 会里子 (慶應義塾大学・特別研究員・神経生理学・形態学実験の遂行)
本橋 淳子 (慶應義塾大学・特別研究員・神経生理学・生化学実験の遂行)
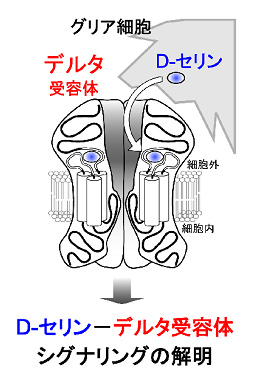
グルタミン酸、ATPおよびD-セリンをはじめとする「グリオトランスミッター」は、グリア-ニューロン相互作用の中核的機構を担う。中でもD-セリンは、NMDA型グルタミン酸 (NMDA) 受容体のリガンドとして、記憶・学習や神経細胞死に深く関与することが知られている。しかし、D-セリンの産生・放出機構など未解明な点が多く、とりわけ、ニューロンへの作用様式については、NMDA受容体を介する経路以外にほとんど分かっていない。我々は近年、D-セリンの受容体分子として、小脳プルキンエ細胞に発現するデルタ2型グルタミン酸 (デルタ2) 受容体に着目し、デルタ2受容体へのD-セリン結合がシナプス可塑性および運動記憶・学習を調節することを明らかにした。また、デルタ2受容体と同族分子であるデルタ1受容体は大脳・海馬・線条体・小脳など様々な脳部位に特異的に発現し、D-セリンとも結合することが報告されている。そのため、D-セリン-デルタ受容体シグナリングは、脳全域で観察される普遍的かつ新しいグリア-ニューロン相互作用を制御している可能性が示唆される。そこで本研究では、この新規D-セリンシグナリングの分子機構と機能的役割について追究する。
研究代表者:宮田 信吾(近畿大学 東洋医学研究所 分子脳科学研究部門・准教授)
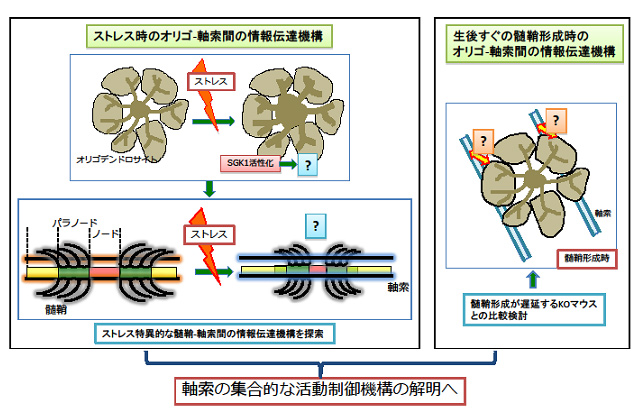
グリア細胞は別名、神経支持細胞と名付けられていることからも神経細胞を補佐する存在としての地位しか長年得られていなかった。しかしながら最近になり、髄鞘形成後の軸索と髄鞘/オリゴデンドロサイト(OLs)間に活発な細胞間情報伝達機構が存在する可能性が示された。さらに、複数の軸索が一つのOLsにより髄鞘化される事実と合わせて考えると、成熟後の線維束では同じ集合体内の複数の軸索を指令的にOLsが制御して神経活動伝達を調整している可能性が示唆されるが、この仮説を解明する為の包括的な検討はなされていない。研究代表者はこれまでに、ストレス負荷によるSGK1活性化がOLsの構造異常を誘導すること、さらには髄鞘/ランビエ絞輪部の脱随ではない構造異常が神経伝達レベルに影響を及ぼす可能性を見出してきた。そこで本研究では、脱随ではないこの構造異常が髄鞘-軸索間の細胞間情報伝達機構にどのような影響を及ぼすのか、さらには髄鞘形成時に機能する因子のKOマウスを用いて髄鞘形成に重要な役割を果たす軸索との細胞間情報伝達機構を解析することにより、ひとつのOLにより複数本制御されている軸索の集合的制御機構解明に迫りたい。
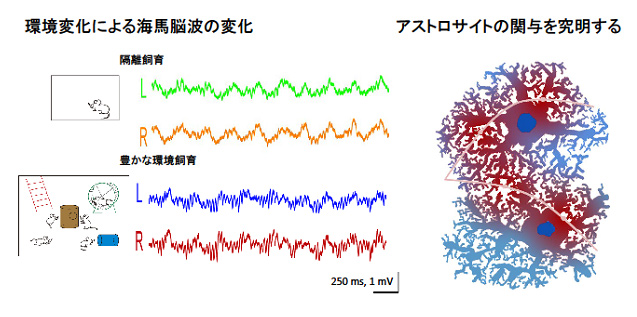
研究代表者:平瀬 肇(理化学研究所脳科学総合研究センター・チームリーダー)
動物の記憶や学習は、シナプス可塑性を中心とする神経回路の機能変化により実現されている。我々はコリン作動性線維の刺激により誘発される大脳皮質体性感覚野のアストロサイトCa2+上昇が、感覚刺激応答を増大させることを見出し、アストロサイトもシナプス可塑性に重要な細胞であることを提唱してきた。しかし、アストロサイトが無麻酔下の自然な状態で起きる神経回路の可塑性に重要であるかは、よくわかっていない。そこで、本研究では、経験に依存した神経回路の再編に伴う「神経細胞の周辺環境の変化」をアストロサイトに着眼して詳細に調べる。具体的には、ヒゲ切除と飼育環境変化によりそれぞれ、大脳皮質と海馬の神経回路に慢性的な可塑的変化を起こし、アストロサイトのCa2+活動(あるいは他の機構)が、自然な状態で起こるシナプスの可塑的変化に寄与しているのかを見極めたい。