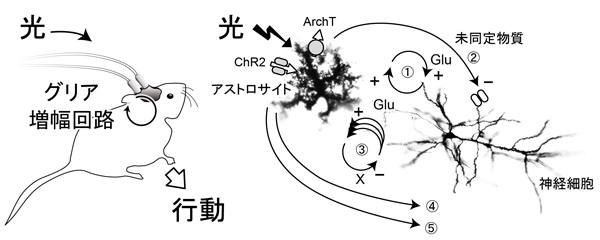
研究代表者:松井 広(東北大学大学院 生命科学研究科 超回路脳機能分野 教授)
全ての経験は、少なくとも一時的には自動的に記憶される。取るに足らないイベントも、その日のうちなら大抵は覚えているということは、電気的信号が脳回路を回り続けることによって記憶が維持されているというより、脳回路自体が、常にダイナミックな可塑的変化をし続けていることが示唆される。しかし、残る記憶と消えていく記憶とを分けているのは何であろうか。本研究では、グリア細胞による神経信号の増幅があって、初めて、定着する記憶が生まれるという仮説を検証する。本研究では、グリアの作用を自在に操作する光遺伝学を利用して、グリアの作用と記憶の形成の関係を明らかにする。前回の公募研究では、グリア活動が暴走する虚血状態での病態モデルを研究し、グリア作用を強力に惹起する細胞内pHに注目した。今回の公募では、病態時だけでなく、健常時の学習・記憶過程でも、程度の差こそあれ、同じ原理のグリア作用が稼働している可能性を検証する。
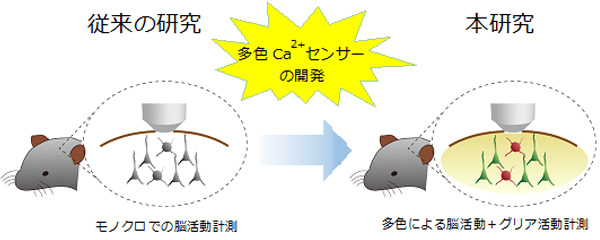
研究代表者:尾藤 晴彦(東京大学大学院 医学系研究科 神経生化学分野 教授)
我々はこれまでに線形性が高く低濃度カルシウム上昇も鋭敏に検出できる高速Ca2+インディケーター(GECI)R-CaMP2を創出し(Inoue et al. Nature Methods 2015)、さらなる色変異体をも作出した。本研究では、1)異なる色のGECIを神経細胞終末とポストシナプスとグリア細胞に発現する、2)シナプス酵素反応をYellow-to-Red FRETにより可視化するとともに、グリア細胞の活動動態を青色GECIを指標に計測する、の2つの戦略を実行する。前者では、プレポストの神経活動とグリア活動の相関を、後者では、個々のスパイン可塑性シグナリングとグリア活動の同時可視化を試みる。さらにウィルスベクターを用い、in vivoにおいて局所的なシナプス活動と、マクロ的グリア活動がどのように関係しているか、可視化し、神経活動とグリア活動の時空間的相関について検討する。
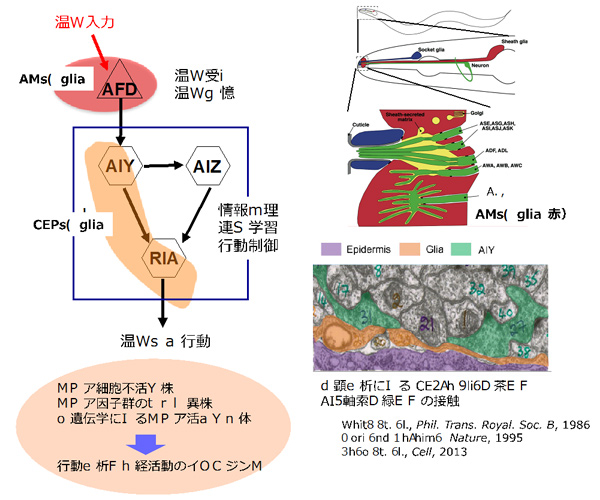
研究代表者:森 郁恵(名古屋大学大学院 理学研究科 生命理学専攻 教授)
線虫 C. elegans の神経系は、302個の神経細胞と56個のグリア細胞から構成され、それらの位置や形態に、ほぼ個体差がみられないステレオタイプな構造を特徴とする。本研究では、外界の温度を感知・記憶する感覚神経細胞AFD、情報の処理・統合および運動制御を担う介在神経細胞AIY、AIZ、RIAからなる少数の神経細胞で制御される、可塑的な行動である温度走性を行動パラダイムとし、グリア細胞の機能を、分子・細胞レベルで探る。具体的には、グリア細胞を不活化した株、グリア因子群の突然変異株、光遺伝学によりグリア細胞を活性化させた個体に関して、申請者の研究室が独自に編み出した温度勾配上での行動実験を行い、グリア細胞が行動に与える影響を明らかにする。さらに、温度走性に関与する神経細胞の活動をカルシウムイメージングにより捉えることと合わせて、グリアが神経系機能を制御するメカニズムを読み解く。
研究代表者:木下 専(名古屋大学大学院 理学研究科 生命理学専攻 教授)
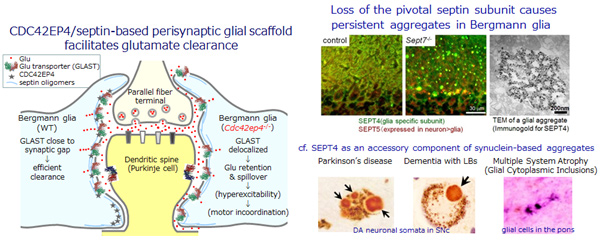
我々は、小脳の放射状グリアであるバーグマングリア細胞突起内のCDC42EP4/セプチン複合体が、グリア突起先端のシナプス間隙への嵌入とグルタミン酸トランスポーターの集積を介してグルタミン酸クリアランスを促進し、運動学習に必須の役割を果たすことを示した(Nat Commun 2015)。この系は網膜のミュラーグリア細胞や中枢神経全域のアストロサイトにも存在し、興奮性シナプスにおけるグルタミン酸回収の効率化に寄与しているものと推測されるが、不明な点が多い。そこで、バーグマングリア細胞選択的にセプチン重合の要となるサブユニットSEPT7を欠損させてセプチン細胞骨格系を破綻させたところ、細胞質内に多数の凝集体が残留する興味深い現象を見出した。パーキンソン病および関連疾患ではセプチンがシヌクレインと共凝集することから(Neuron 2007)、この系を活用して生理機能を解析し、病態との関連を探索する。
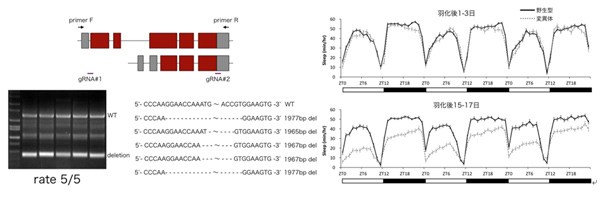
研究代表者:上野 太郎(東邦大学 理学部 生物分子科学科 講師)
近年、グリア細胞の活性によって睡眠覚醒や体内時計が制御されていることが指摘されているが、その分子メカニズムは不明である。これまで、私はショウジョウバエを用いた睡眠研究を行うことで、睡眠制御に関わる遺伝子や神経回路を同定してきた(Ueno et al. Nature Neuroscience 2012)。CRISPR/Cas9を用いたゲノム編集によりグリア細胞に発現する遺伝子が加齢性記憶障害に関与することを明らかにするとともに(Yamazaki et al. Neuron 2014)、加齢性の睡眠障害に関わることを見出している。本研究では、ショウジョウバエを用いた睡眠研究により、睡眠覚醒ならびに体内時計を制御するグリア細胞の分子基盤を明らかにする。