疾患解説
全身性エリテマトーデス (Systemic lupus erythematosus: SLE)
1.疾患概念と疫学
全身性エリテマトーデス(SLE)は、自己免疫異常によって生じる全身性炎症性疾患である。原因は不明とされているが、遺伝的要因と環境的要因による多因子疾患であると考えられている。遺伝的要因についてはHLA領域のほかに、Fcγ receptor genes, IRF5, STAT4, PTPN22, TNFAIP3, BLK, BANK1, TNFSF4, ITGAMといった免疫に関連する遺伝子群がリスク遺伝子として同定されている(Deng Y, et al. Nat Rev Rheumatol. 2010. 6:683-692)。また環境的要因として紫外線やウイルス感染、ホルモンの影響が示唆されている。
自己免疫異常についての仮説は以下のとおりである。細胞死に由来する過剰な核酸がTLRなどの自然免疫系の受容体(pattern recognition molecules)を介して形質細胞様樹状細胞(plasmacytoid dendritic cell, pDC)を活性化し、I型interferon (IFN)の過剰産生が誘発される。IFNによる獲得免疫系の活性化により、T細胞、B細胞の異常な活性化が生じ、また過剰な抗原提示の結果、免疫寛容の破綻が生じ、抗核抗体、抗DNA抗体を含む自己抗体が出現する。そして、自己抗原と自己抗体による免疫複合体が形成され、Fc受容体を介した免疫細胞刺激による炎症の継続、免疫複合体の血管壁への沈着による組織炎症の誘導などが生じ、SLEに特徴的な皮膚、腎臓、神経、肺などの炎症が誘導されると考えられている。ほかにも、クームス抗体などによる溶血性貧血など、抗体による細胞障害・組織障害もみられる(Tsokos GC. N Engl J Med. 2011. 365:2110-2121)。
有病率は人口10万人当たり33人とされ、本邦の患者数は、特定疾患医療受給者証の所得者数 (2006年)より、54,000人と推定される。男女比は、1:9と女性に大きく偏っており、好発年齢は、20-40歳と若年に多い疾患である。高齢発症症例では、男性の比率がやや増える。
過去には予後不良の疾患であったが、1990年代以降、免疫抑制剤の導入により、5年生存率95%、10年生存率90%と改善がみられるようになった。一方で再燃を反復する難治例の存在や、死因としては海外・日本とも感染症が約30%、心血管障害が15-25%と、解決すべき問題は多く残されている状況である。実際、SLE患者の心筋梗塞発症リスクは健常者と比較して2.3倍、心不全発症リスクは3.8倍と有意に高いとされている。
2.症状と徴候
全身に様々な症状が生じうる。皮疹や漿膜炎のような診断に重要な所見、重要臓器障害を示唆する所見を見逃さないようにする。
1) 全身症状:
- 発熱、全身倦怠感、体重減少、リンパ節腫脹
2) 頭頸部:
- 脱毛 (DLEに伴うものは不可逆なことがある)、円板状皮疹 (特に頭皮、まれに耳介、口腔内) 、口腔内潰瘍 (無痛の浅い潰瘍、硬口蓋に多い)、上強膜炎、角結膜炎、網膜症
3) 皮膚症状:
- 急性皮膚ループス:顔面の蝶形紅斑(鼻梁をこえない)、光線過敏性紅斑、斑状丘疹(顔面、V neck, 前腕など)、水疱、中毒性表皮剥離症
- 亜急性皮膚ループス:乾癬様皮疹、環状紅斑
- 慢性皮膚ループス:円板状皮疹(Discoid疹)、脂肪織炎、凍瘡様皮疹
- 循環障害:レイノー現象、爪周囲紅斑、爪周囲梗塞、網状皮斑
4) 筋骨格:関節痛・関節炎・腱鞘炎 (非破壊性、MP/PIPおよび手関節に多い)
- Jaccoud変形(腱や靱帯のゆるみが原因で生じる)
- 筋肉痛、筋炎
5) 心・肺症状:胸膜炎・胸水 (胸膜摩擦音の聴取)、心膜炎・心嚢水 (心膜摩擦音の聴取)
- 間質性肺炎
- 肺高血圧 (US上、RVSP≧35mmHgの場合疑われる)
- 肺胞出血(血痰、呼吸苦)
- Shrinking lung
- Libman-Sacks 型心内膜炎
- Libman-Sacks型心内膜炎は、APSを伴うSLEにみることが多いといわれているが、最近はかなり頻度が低い。血栓性疣贅(フィブリン、顆粒状の好塩基性ヘマトキシリン体、変性細胞、線維性組織から構成され、IgGと補体の沈着をみる)を僧帽弁や三尖弁に認め、進行すると弁膜の肥厚を来たし、弁機能不全へと至る。
6) 消化器症状:肝腫大、肝機能異常 (ルポイド肝炎)、脾腫
- 腹水、腸間膜の血管炎
- 蛋白漏出性胃腸症
7) 腎臓:
- 浮腫、尿所見異常(蛋白尿、各種円柱)、 腎機能異常
8) 中枢神経:
- 意識障害、高次機能障害、痙攀、精神症状、脳梗塞、髄膜炎、脊髄炎
9) 末梢神経障害:
- 多発性単神経炎、末梢神経症状(しびれ、麻痺)
3.検査
1) 血液学的検査
- 血球減少:貧血(溶血性、慢性炎症、鉄欠乏性、腎性など原因は様々)、白血球減少症(<4000/μL)、リンパ減少症、 血小板減少症(<10万/μL) (自己免疫性が多いが、TTPやMASなどの可能性もある)
- 血清補体価:CH50, C3, C4 SLE活動性亢進で低下。一部の病態(V型腎炎など)では低下がなくても活動性あり。
- 炎症反応:ESR亢進、CRP(関節炎、漿膜炎があるときは上昇するが、CRP上昇がみられないことがSLEでは特徴的とされる)
- ガンマグロブリン:一般には上昇
- 生化学:腎機能、肝機能、CK、フェリチン等
- 凝固:aPTT延長(APS)、D-dimer上昇
2) 血清自己抗体の検出
- ANA陽性 (ANA40倍は、正常健常者においても20%陽性である。ACR/EULAR 2019分類基準ではANA x80以上をエントリー基準としている)、homogenous, peripheral patternがSLEに特異性が高い。Speckledのことも多い。
- 抗ds-DNA抗体
- 抗 Sm抗体 (SLEの10〜15%で陽性, 特異度が高く、分類基準にも採用)
- 抗SS-A / SS-B抗体
- 抗RNP抗体(SLEの30%にみられる)
- 抗リン脂質抗体(ループスアンチコアグラント(LAC)、生物学的偽陽性、抗CL-β2GP1抗体、 IgG抗CL抗体陽性 / IgM抗CL抗体陽性, SLEの30-40%にみられる。
- 直接クームス試験 溶血性貧血と関連
- PA-IgG, 抗GPIIb/IIIa抗体 血小板減少と関連
- 抗リボソーマルP抗体 NPSLE, 肝障害と関連
- 抗NR2抗体 NPSLEと関連
3) 臓器特異的検査・画像診断
尿検査(定性・沈査・蛋白尿)、胸部レントゲン(胸膜炎)は必須
CT, MRI, SPECT, 脳波, エコー, 胸水穿刺, 髄液穿刺, 眼底検査など病態に応じて検査を行う
- 胸水 滲出性胸水、胸水中の補体低下、ANA陽性
- 髄液検査 IgG index上昇, 髄液IL-6上昇
4) 生検・病理学的検査
- 皮膚:液状変性、真皮のムチン沈着、炎症細胞浸潤、ループスバンドテスト陽性
- 腎生検:ループス腎炎各論参照
4.診断
1) 分類基準:
従来、1997年の分類基準 (表1)を用いていた。しかし、補体低値が基準に含まれていないこと、11項目中4項目陽性で分類可能となるが、3項目しか満たさなくてもSLE以外の疾患が考えにくい症例があること、皮膚病変が4項目を占めていることなどから免疫学的異常がなくともSLEとの分類が可能となる症例があること、神経学的所見にけいれんと精神症状のみであったことなど、問題が指摘されていた。そのため、2012年ACRより、SLICC (表2)が提唱された。ACR1997とSLICC2012を比較すると、感度は83%から97%に上昇したが, 特異度は96%から84%に低下した。
2019年ACR/EULARの新分類基準が提唱された(表3)。SLICCに比して、感度96%と感度と保ちつつ、特異度が93%と上昇している。主な変更点として、スコアリングによる重み付けがなされた、臨床項目に発熱が採用されたといった点がある。一方、エントリー基準がANA x80以上とされたため、"ANA陰性SLE"についてのSLEへの分類は不可能となっている。
表1.1997年のACRの分類基準
| No. | 分類基準 | 説明 |
|---|---|---|
| 1 | 顔面紅斑(蝶形紅斑) | 鼻梁から鼻唇溝へ広がる紅斑, 平坦なことも隆起していることもある |
| 2 | 円板状皮疹 | 角質性鱗屑や毛包性角栓を伴う隆起性紅斑.古い病変部には萎縮性瘢痕を認めることもある. |
| 3 | 光線過敏 | 日光に対する過敏な反応による皮疹 |
| 4 | 口腔潰瘍 | 口腔, 鼻咽頭の潰瘍. 通常無痛性 |
| 5 | 関節炎 | 2ヵ所以上の末梢性の非破壊性関節炎で, 腫脹・圧痛・関節液貯留を伴う |
| 6 | 漿膜炎 | 胸膜炎または心膜炎 |
| 7 | 腎障害 | 尿タンパク(0.5g/日以上もしくは3+以上)または細胞性円柱 |
| 8 | 神経学的異常 | けいれんまたは精神病 |
| 9 | 血液学的異常 | 溶血性貧血、白血球減少(4,000/μL未満)、リンパ球減少(1,500/μL未満)、血小板減少(100,000/μL未満) |
| 10 | 免疫異常 | 抗dsDNA抗体、抗Sm抗体、抗リン脂質抗体陽性 |
| 11 | 抗核抗体(ANA) | 抗核抗体陽性 |
Hochberg MC et al: Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 40:1725-, 1997
表2. The Systemic Lupus International Collaborating Clinics Classification Criteria (SLICC) (2012)
| 臨床11項目 |
|---|
|
1. Acute cutaneous lupus (急性皮膚ループス) |
| 免疫6項目 |
|
1. 抗核抗体 2. 抗ds-DNA抗体 3. 抗Sm抗体 4. 抗リン脂質抗体 5. 低補体血症 6. 溶血性貧血がない場合の直接クームステスト陽性 |
| 臨床11項目と免疫6項目から、それぞれ1項目以上合計4項目認めれば、SLEと分類する。また、抗核抗体もしくは抗ds-DNA抗体陽性で腎生検にてループス腎炎が証明された場合もSLEと分類される。 |
Petri M et al: Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 64: 2677-86,2012
表3.SLE ACR/EULAR classification criteria (2019)
エントリー基準:ANA≧80倍 (Hep2細胞の関節蛍光抗体法または同等の検査法)
| 臨床項目 | 点 |
|---|---|
| 全身症状 発熱 (38.3℃以上) |
2 |
| 皮膚 非瘢痕性脱毛 口腔潰瘍 亜急性皮膚ループスまたは円板状皮疹 急性皮膚ループス |
2 2 4 6 |
| 関節炎 2関節以上の腫脹を伴う滑膜炎 または2関節以上圧痛と30分以上の朝のこわばり |
6 |
| 神経 せん妄 精神症状 けいれん |
2 3 5 |
| 漿膜炎 胸水 または 心嚢水 急性心膜炎 |
5 6 |
| 血液 白血球減少 (<4000/μL) 血小板減少 (<10万/μL) 自己免疫性溶血 (直接Coombsテスト陽性かつハプトグロビン低下等の溶血所見) |
3 4 4 |
| 腎 蛋白尿 0.5g/24hr Class II or V ループス腎炎 Class III or IV ループス腎炎 |
4 8 10 |
| 免疫学的項目 | 点 |
| 抗リン脂質抗体 カルジオリピンIgG 陽性 または CLβ2GPI-IgG 陽性 または LAC陽性 |
2 |
| 補体 Low C3 または low C4 Low C3 かつ Low C4 |
3 4 |
| 特異抗体 抗dsDNA抗体 または 抗Sm抗体 |
6 |
少なくとも臨床項目1項目を含む10点以上で分類
Aringer M et al: 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis. 78:1151-1159, 2019.
そのほか、以下の点に留意してSLEの診断を行う。
- 薬剤性(INH, procainamide, hydralazine, minocycline, 抗TNF阻害剤)の鑑別が必要。
- 感染症(一般細菌、真菌感染、結核、EB virus、パルボウイルスなど)の検索は、十分に行う。
2) 活動性の評価
SLEの疾患活動性の指標としては、SLEDAIもしくはBILAG index (2006年改訂)が有名である。SLEDAIは原文に加えて、それを改変したSELENA-SLEDAI、SLEDAI-2Kが使用されることが多い。症状や検査値の異常について、ぞれぞれ点数がつけられる(表4参照)。SLEDAI、SELENA-SLEDAI、SLEDAI-2Kでは評価期間、および、関節炎や蛋白尿等の各項目の細かい定義が異なる。
表4. SLEDAIに含まれる項目
| 項目 | 点数 |
|---|---|
| 痙攣 | 8 |
| 精神症状 | 8 |
| 急性混迷状態 | 8 |
| 視力障害 | 8 |
| 脳神経障害 | 8 |
| ループス頭痛 | 8 |
| 脳血管障害 | 8 |
| 血管炎 | 8 |
| 関節炎 | 4 |
| 筋炎 | 4 |
| 尿検査での赤血球円柱・顆粒円柱 | 4 |
| 血尿 | 4 |
| 蛋白尿 | 4 |
| 膿尿 | 4 |
| 皮疹 | 2 |
| 脱毛 | 2 |
| 粘膜障害 | 2 |
| 胸膜炎 | 2 |
| 心膜炎 | 2 |
| 低補体血症 | 2 |
| 抗DNA抗体 | 2 |
| 発熱 | 1 |
| 血小板減少 | 1 |
| 白血球減少 | 1 |
Bombardier et al. Arthritis Rheum 35:630-40,1992.
Gladman et al. J Rheumatol 29:288-91,2002.
Petri et al. N Engl J Med 353:2550-2558,2005.
BILAGは、28日前からの症状・検査の異常を8種類(全身症状、粘膜皮膚症状、神経症状、筋骨格病変、心肺病変、血管炎、腎病変、血液異常)に分け、それぞれについて治療の必要性を下記のような5つのカテゴリーに分ける。カテゴリーAは強い治療が必要(具体的にはPSL≧20mg+免疫抑制剤)、カテゴリーBは軽い治療が必要(具体的にはPSL<20mg±免疫抑制剤±NSAIDs)、カテゴリーCは対症療法、カテゴリーDは機能補助つまり過去の病変はあるが治療の必要はない、カテゴリーEは障害がないため無治療と規定されている。総スコアは、カテゴリーAが9点、Bが3点、Cが1点、DおよびEが0点、総スコアは72点となっている。
5.治療
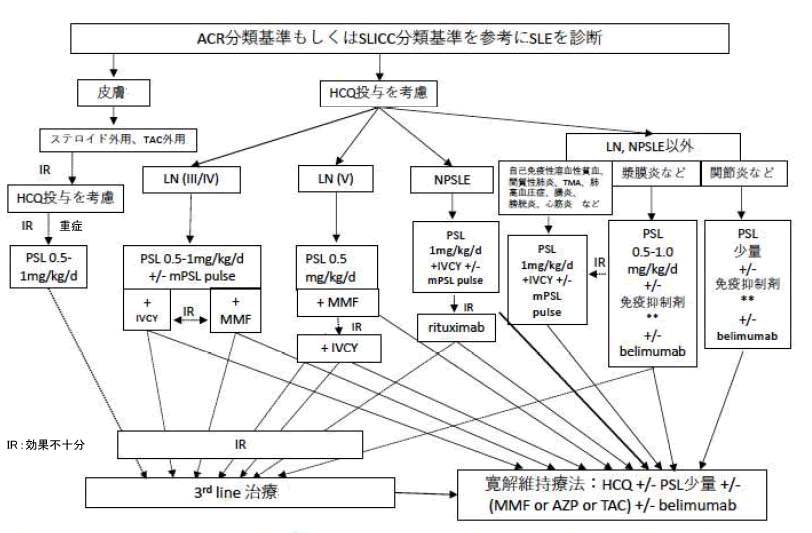
SLEの治療方針については、疾患活動性、臓器障害の分布により決まる。
2019年に本邦からは下図のような治療アルゴリズムが提唱された。そのほか、国際的な指針としては、2023年のEULARの推奨(Fanouriakis A et al. EULAR recommendations for the management of systemic lupus erythematosus: 2023 update. Ann Rheum Dis. 83: 15-29. 2024.)や2024年のKDIGOのループス腎炎のガイドラインも有名である(Rovin BH et al. KDIGO 2024 Clinical Practice Guideline for the management of Lupus Nephritis.Kidney Int.105: S1-S69, 2024.)。
具体的な治療薬としては、病態や重症度に応じて、ヒドロキシクロロキン(hydroxychloroquine、HCQ)、免疫抑制剤、生物学的製剤、グルココルチコイドなどが使用される。以前は治療の中心であったグルココルチコイドについては、長期使用に伴う副作用も多いことから、最近のガイドラインにおいては、急性期の症状を抑えるための必要最低限の使用にとどめ、速やかにPSL5mg/日以下まで漸減、可能なら中止することが推奨されている。
近年、SLEに対して様々な治療の選択肢が増えつつある。2018年にはベリムマブが認可され、軽症例および維持目的の使用のほか、BLISS-LNの結果より腎炎に対する有効性も証明されたため使用が広がっている。2021年よりインターフェロン受容体抗体であるアニフロルマブが認可されている。また、2023年、公知申請によりリツキシマブ(rituximab)も既存治療で効果不十分なループス腎炎に対して使用可能となった。2024年カルシニューリン阻害薬のボクロスポリンも認可された。国内外で、新規治療薬の治験が実施中であり、今後さらに治療の選択肢が増えることが期待される。
JCR SLEの診療ガイドライン2019より
補助療法として、日光回避、生活習慣の改善(禁煙、体重の適正化、運動)、低用量アスピリン、カルシウム・ビタミンD,ビスホスホネート、スタチン、アンギオテンシン系抑制薬を病態に応じて用いる。SLEは心血管障害のハイリスク群であり、動脈硬化性疾患の予防・治療が重要とされている。
 東京大学医学部附属病院
東京大学医学部附属病院