疾患解説
特発性炎症性筋疾患
1. 疾患概念と臨床病型
特発性炎症性筋疾患(idiopathic inflammatory myositis: IIM)は、歴史的には皮膚筋炎、多発性筋炎、封入体筋炎、悪性腫瘍に伴う筋炎、免疫介在性壊死性筋炎などを包含する疾患で、遺伝要因と環境要因を背景として免疫異常を生じ, 筋肉を主座とし全身臓器の障害を呈する慢性炎症性疾患である。1975年にBohanとPeterにより臨床症候と検査による多発性筋炎/皮膚筋炎の診断基準が提唱され、日常診療で長らく用いられてきたが、近年では筋炎特異自己抗体(myositis-specific autoantibody: MSA)や筋病理組織像により疾患単位を細分化し、病態に即した臨床病像の明確化と治療の最適化が図られるようになってきている。
臨床病型(2004年, 2014年の欧州神経筋センター(ENMC)ワークショップ)
- 皮膚筋炎
- 多発性筋炎
- 抗合成酵素症候群(anti-synthetase syndrome:ASS)
- 免疫介在性壊死性筋症(immune-mediated necrotizing myopathy:IMNM)
- 封入体筋炎
- 非特異的筋炎
*皮膚筋炎、ASS、IMNM、封入体筋炎がIIMの主な4臨床病型と考えられている。1975年のBohanとPeterの提唱による、皮膚症状を有さない筋炎として多発性筋炎の診断に基づく診療は現在に至るまで長らく用いられているが、病理組織学的にIMNM、ASS、封入体筋炎であると(現在では)判別される疾患を内包しており、多発性筋炎という分類の存在を否定する議論もある。
2. 遺伝的背景と疫学
一般人口と比して自己免疫性疾患患者家系においてIIMの発症率が高く、遺伝要因の関与は想定されている(Nat Rev Rheumatol. 2018;14(5):255-68.)。14カ国の2566例のIIM白人患者を対象とした検討では、皮膚筋炎でHLA-B*08:01、多発性筋炎でHLA-DRB1*03:01との関連が見出されている。また、抗HMGCR抗体陽性IMNMとはHLA-DRB1*11:01との相関がある(Arthritis Care Res. 2012;64(8):1233-7.)。日本人での検討では、抗MDA-5抗体陽性DM患者ではHLA-DRB1*01:01, DRB1*04:05との関連が知られ、筋無症候性皮膚筋炎患者のゲノムワイド関連解析ではWDFY4の変異との関連が報告されている(Ann Rheum Dis. 2018;77(4):602-11.)。
疫学
- 多発性筋炎/皮膚筋炎
発症年齢:15歳以下が3%、60歳以上が25%で、中年発症が多い。
性差;小児においては性差がないが、成人では女性に多い(男:女=1:3)。
有病率;10万人あたり2人程度。2021年度の厚生労働省特定疾患治療研究事業における臨床調査個人票の解析では受給者総数は25,000名。 - 封入体筋炎
発症年齢:主に50歳以上で発症
性差:やや男性が多い
有病率:30.8人/100万人と想定され、難病情報センター提示の推計では3,700名。
3. 症状と身体所見
- 全身症状:発熱, 関節痛, レイノー現象, 体重減少など
- 筋症状:
- 上肢:髪をとかす・重いものを持ち上げるなど
- 下肢:立ち上がりなど
- 後頸部筋:枕から頭の持ち上げなど(近位筋症状を尋ねる)
- 咽頭筋:嚥下困難,鼻声,構音障害
- 筋痛(把握痛)
- 筋力低下 徒手筋力テスト(manual muscle test: MMT)で所見をとる
- MMT
0: 筋収縮が全くみられない
1: 筋収縮のみ(関節の運動はみられない)
2: 重力を取り除けば全関節可動域の運動可能
3: 重力に抗して全関節可動域の運動可能
4: 弱い抵抗に抗して全関節可動域の運動可能
5: 強い抵抗に抗して全関節可動域の運動可能 - International Myositis Assessment & Clinical Studies Group(IMACS)による筋炎評価では、MMT-8(1筋肉を10点中で評価、計150点)を用いる
頸部屈筋、三角筋(両側)、上腕二頭筋(両側)、手関節伸筋(両側)、大腿四頭筋(両側)、足関節背屈筋(両側)、大臀筋(両)、中臀筋(両)の筋力低下を評価
- 皮膚症状:皮膚筋炎では特徴的な皮疹がみられる
- ヘリオトロープ疹:上眼瞼部の紫紅色浮腫性紅斑. 通常両側性だが, 左右差や片側性もある.
- ゴットロン丘疹:手指関節背面の角質増殖や皮膚萎縮を伴う紅色丘疹
- ゴットロン徴候:手指、肘、膝の関節伸側の紫紅色紅斑
- 機械工の手(メカニックハンド):両手示指側面にみられる角化性紅斑
- 斑状紫紅斑:首筋・肩の背面(ショールサイン), 前頚部・胸部のV領域(V徴候),
- 爪周囲および爪床の毛細血管拡張
- 皮下石灰化(calcinosis cutis)
- 呼吸器症状:間質性肺炎を合併する場合. 労作時呼吸苦, 空咳など
- 関節痛、関節腫脹
4. 検査
1)炎症・自己免疫に関わる検査
A. 血液検査
- 急性炎症反応(赤沈、CRP)
- 抗核抗体
Speckledパターン:抗TIF1-γ抗体(陰性例もあり)、抗Mi-2抗体、抗SAE抗体、抗NXP-2抗体、抗U1-RNP抗体、抗Ku抗体など
Cytoplasmicパターン:抗ARS抗体、抗MDA5抗体(いずれも陰性例もあり)など
Nucleolarパターン:抗PM/Scl抗体など - 筋炎特異自己抗体:保険診療では、抗TIF1-γ抗体、抗Mi-2抗体、抗MDA5抗体、抗ARS抗体、抗Jo-1抗体、抗U1-RNP抗体は提出可能(2025年2月時点)。
抗ARS抗体:アミノアシルtRNA合成酵素に対する自己抗体。抗Jo-1抗体、抗PL-7抗体、抗PL-12抗体、抗EJ抗体、抗KS抗体の5つをまとめてELISA法で検出する検査が2014年に保険収載された(PLoS One 2013;8:e60442)。筋炎において、抗Jo-1抗体(抗ヒスチジルtRNA合成酵素抗体)は15〜30%、抗PL-12抗体(アラニンtRNA合成酵素)は2〜5%、抗PL-7抗体(スレオニンtRNA合成酵素)は2〜5%、抗EJ抗体(グリシンtRNA合成酵素)は2〜5%、抗OJ抗体(イソロイシンtRNA合成酵素)は<2%、抗KS抗体(アスパラギン酸tRNA合成酵素)は<2%で陽性とされる(Autoimmun Rev. 2014;13(4-5):367-71.)。
抗ARS抗体症候群は、抗tRNA合成酵素抗体が陽性であり、関節炎、間質性肺炎、機械工の手を高率に伴う筋炎の一病型。
抗Mi-2抗体:Mi-2はヒストン脱アセチル化酵素と複合体を形成しクロマチンリモデリングに関与する。CK著明高値で重度の皮疹を伴うことが多い。抗核抗体がspeckledで高力価陽性となる。
抗TIF1-γ抗体:成人では70%以上で悪性腫瘍を併存するため悪性腫瘍の検索が重要である。嚥下障害とも関連が知られる。しばしば広範囲の浮腫性・炎症性皮疹を伴う。
抗MDA5抗体:皮膚症状のみを呈し筋炎症状を欠く皮膚筋炎(=clinically amyopathic 皮膚
筋炎=CADM)の一部は抗MDA5抗体陽性である。抗MDA5抗体陽性CADMは短期的な死亡率が高い急速進行性間質性肺炎を伴うため、診断時に間質性肺炎が重症でなくても、時期を逃さずに多剤併用療法を開始するべきである。
抗SRP(signal recognition particle)抗体:7SRNAと蛋白との複合体であるSRPを認識する抗体が陽性でIMNMを生じる。亜急性の発症経過をとり、治療反応性や機能予後が悪い重症例が多い。心筋や体幹筋も時に障害され、皮疹や間質性肺炎を伴うこともある。壊死性ミオパチーの診断には筋生検が実施される。
抗HMGCR抗体:IMNMを生じ、一部はスタチン使用が誘因となって発症する。悪性腫瘍を合併することもある。
2)鑑別に関わる検査
- 感染症:ウイルス性(インフルエンザ, パラインフルエンザ, コクサッキー, エコーウイルスなど), 化膿性筋炎・壊死性筋膜炎. コクサッキーB, インフルエンザ, パラインフルエンザ, 培養の検査など.
- *参考 ウイルス性筋炎:2週間内の上気道炎・腹部症状と2週間内の回復が特徴
- 内分泌・代謝:甲状腺機能低下症. 甲状腺機能検査.
- 薬剤性:スタチンによる免疫介在性壊死性ミオパチー(抗HMGCR抗体), ステロイドミオパチー, 免疫チェックポイント阻害薬による筋炎など.
- 他膠原病に併存する筋炎:シェーグレン症候群, 混合性結合組織病, 全身性強皮症, 全身性エリテマトーデス. 抗SS-A抗体, 抗U1-RNP抗体, 抗dsDNA抗体, 抗Sm抗体などの抗体プロファイルや疾患特異的障害に関連した検査.
3)筋障害に関わる検査
A. 血液検査
- CK, CK-MBやCKアイソザイム(マクロCK血症(分子量が大きいCKで, 免疫グロブリン結合性とミトコンドリア由来がある)との鑑別), ミオグロビン,アルドラーゼ, トロポニンT, ミオシン軽鎖
B. 尿検査
- %クレアチン係数=(クレアチン/(クレアチン+クレアチニン))×100
成人では10%以下. 不動でも上昇するため, 20%以上を異常ととる場合もある.
疾患特異性はない.- ミオグロビン
ミオグロビン尿では沈査ではRBCを認めずに潜血が陽性となる場合がある.C. 針筋電図
- 筋力低下を伴う活動性筋炎では, 安静時の筋自発電位(陽性鋭波 positive sharp waveや線維性収縮 fibrillation)が豊富に観察され, 治療により減少する. 筋原性疾患間の鑑別よりも, 神経原性疾患と筋原性疾患の鑑別を目的とするが, 必ずしも両者を鑑別できないこともある.
D. 画像
- 筋MRI:脂肪置換・筋萎縮・炎症を把握し, 診断と生検部位の同定に役立つ.
T1WI・T2WI・脂肪抑制T2・STIRで撮影.- 骨格筋CT:筋萎縮や肥大, 脂肪化, 石灰化の評価.
神経原性疾患, 一部の筋ジストロフィーの鑑別に有用.E. 筋生検
- PM/DMに共通してみられる所見
- 1)筋周膜開大,筋内鞘開大,筋線維の大小不同
- 2)筋内鞘優位の炎症細胞浸潤
- 3)全ての非壊死筋線維膜上へのHLAクラスIの発現亢進
- 壊死周囲細胞の殆どがマクロファージの場合はnecrotizing myopathyや中毒性, ジストロフィーなども考慮する。
-
PM DM 炎症細胞浸潤部位 筋線維周囲の筋内膜 血管周囲(免疫グロブリンやmembrane attack complex; MACの沈着など) 浸潤する細胞 CD8陽性Tリンパ球
(細胞障害性T細胞)CD4陽性Tリンパ球
B細胞筋線維壊死 散在性 筋束辺縁
(perifascicular atrophy)- 皮膚筋炎ではMxAの筋線維上の発現, C5b-9の毛細血管沈着
- ASSではMHC class IIの筋線維上での発現
- IMNMでは壊死・再生線維
- 封入体筋炎では縁取り空胞, p62陽性細胞質凝集体
が特徴的に認められる。
F. 心筋病変
- 血液検査;上記、心電図、Holter心電図、心エコー
- 心筋MRI;上記検査より心筋障害疑う場合
G. 咽頭〜喉頭筋群病変
- 嚥下機能評価
- 筋MRI
4)皮膚病変に関わる検査
皮膚科診察、皮膚生検. 基底膜の液状変性、真皮のムチン沈着を認める。
特にCADMの場合には、皮膚生検は診断に重要とされる。
5)肺病変に関わる検査
A. 血液検査
- KL-6、SP-D、SP-A
- 動脈血ガス分析、運動負荷時のSpO2(6分間歩行試験)
- フェリチン:抗MDA5抗体陽性皮膚筋炎に関連する間質性肺炎の重症度の指標になる.(Rheumatology. 2010;49(7):1354-60.)
B. 呼吸機能検査;肺拡散能検査も含める
C. 肺CT
6)悪性腫瘍に関わる検査
- ASSや封入体筋炎を除くIIM全体の悪性腫瘍リスクは一般人口の2〜7倍。
- IIM患者における悪性腫瘍発症の時期は、IIMの発症前後3年間のリスクが高いとされており、特に発症1年前後はリスクがさらに高まるため、IIMの診断時には悪性腫瘍のスクリーニングが重要(Best Pract Res Clin Rheumatol 2022;:101771.)。
- IMACSより、IIMにおける悪性腫瘍スクリーニングとして個々の患者の悪性腫瘍リスクに応じた実践的スクリーニングがガイドラインとして提案された(Nat Rev Rheumatol. 2023;19(12):805-817.)。この中では、臨床病型として皮膚筋炎、MSAとして抗TIF1-γ抗体を高リスク因子、抗ARS抗体や抗SRP抗体を低リスク因子とし、症状としては中等度から重度の嚥下障害、皮膚の壊死所見を高リスク因子、レイノー現象、関節炎、間質性肺炎は低リスク因子として挙げられており、リスクを勘案した悪性腫瘍スクリーニングが望ましい。高リスク患者では、通常のスクリーニングで腫瘍が検出されない場合に、上下部消化管内視鏡検査や18F-FDG PET-CTでの精査も提案されている。
5. 診断
- 診断:炎症性筋疾患の証明, 鑑別疾患の除外, 診断・分類基準(表1〜3)を参考に診断をつける。
- 重症度・活動性指標:侵されている筋の種類と範囲・重症度, 間質性肺炎などの筋外病変を評価。IMACSより、6つの疾患活動性指標の組み合わせにより病勢の改善・悪化を評価する方法が提唱されている(表4)。
(表1)自己免疫疾患に関する調査研究班 皮膚筋炎・多発性筋炎 診断基準
| 1. | 皮膚症状:ヘリオトロープ疹 or ゴットロン徴候 or ゴットロン丘疹 |
|---|---|
| 2. | 上肢または下肢の近位筋の筋力低下 |
| 3. | 筋肉の自発痛または把握痛 |
| 4. | 血清中筋原性酵素(CKまたはアルドラーゼ)の上昇 |
| 5. | 筋炎を示す筋電図変化 |
| 6. | 骨破壊を伴わない関節炎または関節痛 |
| 7. | 全身性炎症(発熱, CRP上昇, ESR亢進) |
| 8. | 筋炎特異的自己抗体陽性(抗ARS抗体(抗Jo-1抗体を含む)、抗MDA5抗体、抗Mi-2抗体、抗TIF1-γ抗体、抗NXP2抗体、抗SAE抗体、抗SRP抗体、抗HMGCR抗体) |
| 9. | 筋生検で筋炎の病理所見:筋線維の変性及び細胞浸潤 |
- 皮膚筋炎 : 1 に加えて,2から9の項目中4項目以上
- 多発性筋炎: 2から9の項目中4項目以上
- 鑑別:感染による筋炎、好酸球性筋炎などの非感染性筋炎、薬剤性ミオパチー、内分泌異常・先天代謝異常に伴うミオパチー、電解質異常に伴う筋症状、中枢性ないし末梢神経障害に伴う筋力低下、筋ジストロフィーその他の遺伝性筋疾患、封入体筋炎、湿疹・皮膚炎群を含むその他の皮膚疾患
(表2)Bohan & Peter 皮膚筋炎・多発性筋炎診断基準(NEJM.1975; 292: 344-7)
| 1. | 四肢近位筋, 頚部屈筋の対称性筋力低下 |
|---|---|
| 2. | 筋原性酵素上昇(CK. ALD, AST, ALT, LDH) |
| 3. | 定型的筋電図所見 i) polyphasic, short, small, motor unit potentials ii) fibrillation, positive sharp waves, increased insertional irritability iii) bizarre high frequency, repetitive discharge |
| 4. | 定型的組織所見:筋線維の変性, 壊死, 萎縮, 再生, 炎症細胞浸潤 |
| 5. | 定型的皮膚症状:ヘリオトロープ疹, ゴットロン徴候, 関節伸側の落屑性紅斑 |
definite: 4項目以上(皮膚筋炎は5を含む)
probable: 3項目以上(皮膚筋炎は5を含む)
possible: 2項目以上(皮膚筋炎は5を含む)
(表3)欧州・米国リウマチ学会の特発性炎症性筋疾患の分類基準(2017年)
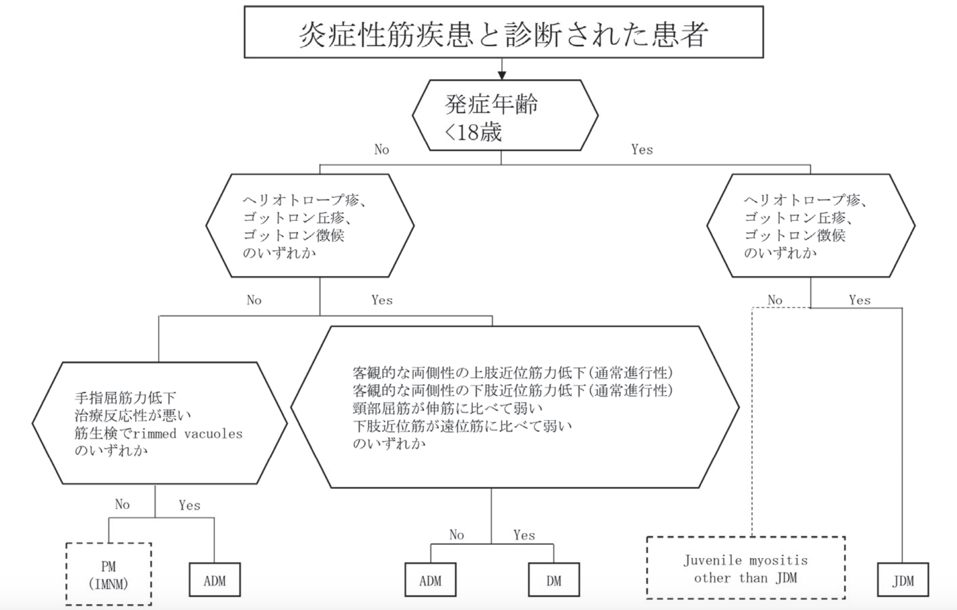 (多発性筋炎と皮膚筋炎診療ガイドライン(2020年), Arthritis Rheumatol. 2017;69:2271-82.がオリジナル)
(多発性筋炎と皮膚筋炎診療ガイドライン(2020年), Arthritis Rheumatol. 2017;69:2271-82.がオリジナル)
| 1 | 医師による全般性活動性評価 | 医師によるvisual analog scale(VAS) |
|---|---|---|
| 2 | 患者による全般性活動性評価 | 患者によるVAS |
| 3 | 筋力(MMT-8、MMT-26) | 近位, 遠位, 体幹の筋肉の徒手筋力テスト |
| 4 | 身体機能評価 | ADLに関する質問票(HAQ), 身体機能, 持久力, 強度等の評価 |
| 5 | 血液検査 | CK, LDH, アルドラーゼ, AST, ALT, Cr |
| 6 | 筋以外の臓器障害 | 皮膚, 関節, 心臓, 肺, 腸管 の評価 |
6. 治療
A. 多発性筋炎, 皮膚筋炎の治療
1)筋肉の炎症に対する治療
第一選択薬は副腎皮質ステロイドで、プレドニゾロン(PSL)0.5〜1mg/kgで開始される。心筋・呼吸筋・咽頭筋障害・高度の骨格筋障害ではステロイドパルスを考慮し、早期より免疫抑制剤(MTX、カルシニューリン阻害薬、アザチオプリン、MMF;薬剤選択の上で保険適応には注意)の併用を考慮する。ステロイド抵抗性の場合には、免疫グロブリン大量静注療法(intravenous immunoglobulin:IVIg)の併用を考慮する。
2)間質性肺炎に対する治療
多発性筋炎/皮膚筋炎関連の間質性肺炎の治療アルゴリズムが日本呼吸器学会・日本リウマチ学会により提案されている(膠原病に伴う間質性肺疾患 診断・治療指針2020)。
- 急性/亜急性の間質性肺炎では、抗MDA5抗体陽性の場合、予後不良なため高用量ステロイド、シクホスファミドパルス、タクロリムスの3剤併用療法を考慮し、抗MDA5抗体陰性の場合には高用量ステロイドと単剤の免疫抑制剤が考慮される。
- 抗MDA5抗体陽性皮膚筋炎に伴う急速進行性間質性肺炎では、治療抵抗性例での使用報告の蓄積から2024年に血漿交換が保険適応となっている。保険適応外ではあるが、多剤治療抵抗性の場合に、リツキシマブやJAK阻害薬等の追加治療による有効性の報告は存在する(Curr Opin Rheumatol . 2024;36(1):61-68.、Rheumatol Int . 2024;44(5):961-971.)。
B. IMNMに対する治療
- 第一選択薬は副腎皮質ステロイドで、PSL 0.5〜1mg/kgで開始し、病勢を判断しながら漸減を進める。ステロイド抵抗性の場合には、免疫抑制剤(アザチオプリン、タクロリムス、MTX、MMFなど)の併用を考慮するが、保険適応には注意が必要である。
- 2016年にENMCワークショップで提言されたIMNMの治療指針では、1mg/kgのステロイドに加え、抗SRP抗体陽性例の追加治療として、第一にMTXまたはリツキシマブ、第二にIVIg、抗HMGCR抗体陽性例の追加治療として第一にMTXまたはIVIg、第二にリツキシマブとされている(Neuromuscul Disord. 2018;28(1):87-99.)。
 東京大学医学部附属病院
東京大学医学部附属病院








