- HOME
- 支援利用者・支援者インタビュー
- 白石 航也
支援利用者・支援者インタビュー
免疫遺伝子の多様性と肺腺がんの発症リスクとの関連を発見
〜HLA遺伝子の多様性が、日本人に多いタイプの肺腺がんリスクを高める〜
白石 航也
国立がん研究センター研究所臨床ゲノム解析部門 部門長・ゲノム生物学研究分野ユニット長
細菌・細胞の研究から疫学へ「多様性が魅力」
大学の学部時代は、薬学部で学んでおり、卒業後も細菌・細胞の形態の違いやDNA修復活性に関わる遺伝子の探索研究をしていた。
実験室で使われる細菌・細胞は種類も限られており、また遺伝的なばらつきは少ない。しかしあるDNA修復に関わる一つの遺伝子を働かないようにして実験すると、ほかの修復遺伝子が代わりに働いて修復能力は変わらない細胞、それができず修復能力が落ちてしまう細胞があらわれる。修復能力がどのくらい回復できるかは、細菌や細胞株間によっても異なっている。このことは、ヒト細胞でも同じであり、そのころから、遺伝的な違いや、それが生み出す病気、それを克服する方法にも関心をもつようになった。

国立がん研究センターに職を得てから、疫学の分野に取り組み始めた。疫学の魅力は、ヒトを対象とした遺伝子の多様性の問題に取り組めることだったという。
実験用に培養され続けている細菌や細胞株とは異なり、人間は千差万別だ。お酒の好きな人、嫌いな人、あるいは肉が好きな人や魚が好きな人、たばこを吸う人吸わない人など、遺伝子の多様性の他にも生活習慣や環境要因などとても多様性がある。その雑多な特性を持つ集団から、発がん要因を見つけたり、それが関わる法則を探り当てたりするのが疫学の醍醐味だという。
現代の疫学は、膨大なデータを扱うデータサイエンスとしての側面も大きくなりつつある。とはいえ、データサイエンティストと疫学の研究者では役割が異なる。データサイエンティストはデータの山の中から、違うパターンのものを取り出してくることに長けている。一方、疫学者は、数値だけではわからない生物学的な背景をもとに仮説を立て、それを検証していく。そんな少しファジーな部分に、生きた生物を扱う実験をしていた経験が「ちょっとだけ生きているかもしれない」と白石氏は話す。
免疫にかかわるDNA配列のわずかな違いがリスク要因に
白石氏らのチームの最近の成果の一つが、肺腺がんの発病に、どんな遺伝子の多様性、変異が関わっているかの研究だ。"変異"には、がん細胞で蓄積される体細胞変異と、両親から受け継がれる遺伝子の多様性である生殖細胞系列変異がある。

日本では、がんは死因のトップで、その中でも肺がんが一番多い。肺がんの中にも肺腺がん、扁平上皮がんなど様々なタイプがあるが、肺腺がんがもっとも発症頻度が高く、増加傾向にある。
肺がんは、喫煙すると罹りやすくなることが知られているが、肺腺がんは喫煙との関連が比較的弱く、約半分は非喫煙者が発症している。そのため他の危険因子がわかれば、予防に役立つと期待されていた。
また日本人と欧米人の肺腺がんを比較すると、EGFR(上皮増殖因子受容体)遺伝子に体細胞変異を持つがんが日本人には多いことが知られていた。欧米人の約10%に対し、日本人では約50%にのぼっていた。日本人などアジア人に特有の遺伝子の多様性が、肺腺がんのかかりやすさに関わっているのではないか、それも知りたい。
そこで、国立がん研究センターや、全国各地の大学病院などで収集された肺腺がんの患者(EGFR変異を持つ肺腺がん3,173人、この変異を持たない肺腺がん3,694人)と、がんに罹っていない人15,158人の血液や、がん組織以外のDNAを集め、遺伝子にどんな違いがあるか、GWAS(ゲノムワイド関連解析)という方法で調べた。
その結果、六つの遺伝子領域におけるDNA配列のわずかな違いが、EGFR変異陽性の肺腺がんへのかかりやすさに関わっていることを見つけ出し、Nature Communications 2016年8月9日号で発表した。
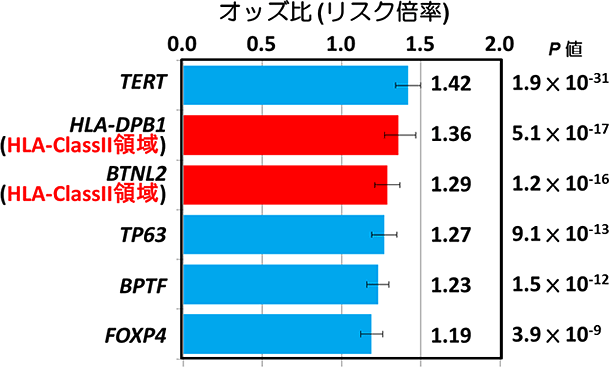
図1 遺伝子の個人差によるEGFR変異陽性肺腺がんへの危険度の違い
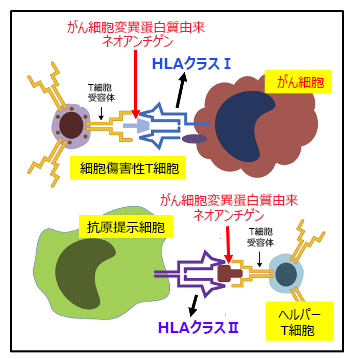
図2 HLAタンパク質が、免疫反応で異物(がん細胞)を認識するときに重要な働きをしている。
特に注目されたのは、六つの遺伝子領域の一つが、ヒトの免疫に関わる重要な分子であるHLA(ヒト白血球抗原)遺伝子の領域でのDNA配列の違いが、肺腺がんになるリスクと関係していることだった。「HLAの多様性が、肺腺がんの発症に重要な役割を果たしているようだ」と白石氏は言う。
免疫系が自分の細胞(自己)と異物を見分ける時に、HLAは重要な役割を果たしている。免疫細胞が、がん細胞を早い段階で異物と認識して殺してしまうことができれば、がんは広がらない。一方、認識できなければ、がん細胞は生き残って大きくなってしまう。免疫の働きからうまく逃れられるか、逃れられないかは、がんの発症に関わっている。EGFR変異陽性の肺腺がんになりやすいかどうかも、その免疫反応の個人差に関わっているらしい。
HLAの領域はもともと遺伝子の多様性に富んでいるため、従来はGWASでも探しにくい領域だったが、解析する技術が発達してきたおかげで、発がんリスクとの関連が調べられるようになった成果だった。
バイオベンチャーでの営業経験がプロジェクト進行に生きた
GWASの研究には、とても多くの研究者が関わっている。いろんな病院で、患者さんから研究への参加の同意を頂き血液や組織を集めてくる人、そうやって集めた血液や組織の試料からDNAを抽出し遺伝子型を決める人、そのデータを解析する人、成果をとりまとめて論文にする人。何十人もの人が関わっている。
白石氏は、研究プロジェクトを引っ張っていくには「研究に対する熱い思い」を現場まで伝えるのが大切だという。メールだけでは思いが伝わらない。コロナ禍で最近は難しくなったが、直接会って話をしたり食事をしたりしてコミュニケーションをとることが大切だと考えている。
大学卒業後、バイオベンチャーにも就職し、営業の仕事も経験したことがある。その時に病院を回って検査方法を説明した経験が生かされているかもしれないという。

そして、各施設で集めってもらった成果から生まれた論文を、きちんと発信していくことも重要だ。「成果が出ているのかわからないと現場で思われてしまうと、協力を続けてもらうことが難しくなります」。
コホート・生体試料支援プラットフォーム(CoBiA)の支援で、コホート試料として集められていた肺腺がん患者さんのDNAを分与してもらい、研究の検出力を高め、確からしさを向上させることが出来た。
通常の共同研究であれば、一つ一つの共同研究先から、患者さんの同意を得て集めてもらった血液を国立がん研究センターで集め、DNAを抽出する作業が必要になる。
一方、CoBiAからは、すでにDNAになった形で提供してもらえるので、研究の工程がかなり短縮されるという。
「より多くの患者さんのデータが使えるようになるとともに、検出できる遺伝子の多様性も増えてきました。多くの遺伝要因と、環境要因との相互作用なども含めて総合的にリスクを評価する研究も進んでいます。その成果を、病気の予防にどうつなげるか、そこに疫学研究者の知恵がますます問われるようになってきました」と白石氏は話している。
(2022年5月25日インタビュー)
*感染対策を行い、取材・撮影を行いました。
 白石 航也(しらいし・こうや)
白石 航也(しらいし・こうや)
国立がん研究センター研究所臨床ゲノム解析部門 部門長・ゲノム生物学研究分野ユニット長
千葉県出身
1998年 北里大学 薬学部 薬学科卒業
2001年 北里研究所基礎研究所 研究員
2007年 北里大学大学院 薬学研究科論文博士号(薬学) 取得
2008年 財団法人がん研究振興財団 リサーチレジデント
2011年 国立がん研究センター研究所 ゲノム生物学研究分野 研究員
2017年より現職
2022年より国立がん研究センター研究所 基盤的臨床開発研究コアセンター 臨床ゲノム解析部門 部門長も兼任
支援利用者インタビュー
【イベントお知らせ】📢先進ゲノム支援プラットフォームが情報解析講習会(中級)を開催します!
— 生命科学連携推進協議会 (@platform_imsut) January 29, 2026
◇日時:2/20(金)10:00~16:00 (Zoom)
◇参加費無料
※ご参加には受講登録が必要です。
登録締め切り🔔【 2/9(月)】
ご登録・詳細はこちら▶️https://t.co/noZxGChOB1 https://t.co/TQO8qrM3HH







