- HOME
- 支援利用者・支援者インタビュー
- 岸 雄介
支援利用者・支援者インタビュー
クロマチンの「かたち」から見る脳の過去と未来
〜クロマチン構造に刻まれた記録をゲノム解析で読む〜
岸 雄介
東京大学 定量生命科学研究所 先端定量生命科学研究部門 分子神経生物学研究分野 准教授
神経幹細胞がこれから変化できる能力が分かる
記憶は、脳のどこに書き込まれているのだろうか。
岸雄介・東京大学定量生命科学研究所准教授は、最新のゲノム解析技術から、この謎に迫ろうとしている。

注目しているのは、細胞の核に含まれるクロマチン構造だ。
真核生物が持つDNAは、とても細くて長い。たとえば人間では、一つの細胞に入っているDNAの長さは約2mにもなる。細胞の中にうまく収納するために、DNAは、ヒストンタンパク質に巻きついて、糸を通したビーズの連なりのような構造をとっている。これがクロマチン構造と呼ばれる(図1)。
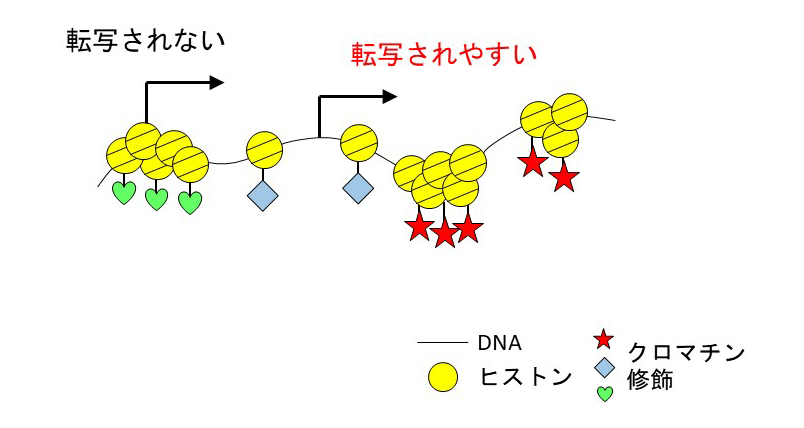
図1 クロマチン構造と転写のしやすさ
クロマチン構造がギュッと凝集した状態では、DNAは読み取りにくいので、さまざまな機能を持つ遺伝子は発現しにくい。一方、クロマチン構造が緩んだ状態では、DNAを読み取ることができる、すなわち遺伝子が転写されやすくなる。
このようなクロマチンの構造、すなわち「かたち」の変化が、脳神経系を構成する細胞の過去や未来と密接に関わっているのではないかと、岸准教授は考えている。
最初に手がけたのは、神経幹細胞の未来とクロマチン構造の関連を明らかにする研究だった。神経幹細胞は分化して、ニューロンやグリア細胞など、脳を構成する細胞になる。
岸准教授らは、ネズミの脳の中から神経幹細胞を取り出して実験した。すると受精後11日目ぐらいの神経幹細胞ではクロマチン構造が緩んでDNAが読み取りやすい状態になっていたのに、それから約1週間後のニューロンに分化する能力が低下した神経幹細胞を調べるとクロマチン構造は凝集した状態に変化していた。
「培養細胞ではなく、生きたネズミの実際の脳の中にある神経幹細胞を使って明らかにできたのが重要な点です。神経幹細胞がどの細胞に変化できるかという未来の可能性が、クロマチン構造でうまく制御されている様子が見えてきました」
クロマチン構造に刻まれた過去の記録
現在は、ネズミが過去に受けた経験と、ニューロンのクロマチン構造の関係を探っている。長生きした、ストレスを受けた、というような経験が、クロマチン構造から読み出せないか、その方法を研究中だ。

生後7週ぐらいの若いネズミと、寿命が近づいた2歳ぐらいの老齢ネズミの脳の海馬の領域にあるニューロンからクロマチン構造を集めて比較した。海馬は、短期記憶に関わる領域だ。
一匹のネズミの脳のニューロンを取り出し、そのクロマチン構造がどんな状態になっているかを約15種類の解析方法で同時に観測し、結果を組み合わせて分析する方法を開発した。これを使えば、若いニューロンか、老化しているニューロンなのか、高い精度で区別できることがわかった。
「何かを覚えるときなど脳が働くとき、老化に伴うクロマチン構造の変化によって、若い時とは違う遺伝子の応答、発現を引き起こすのではないか。そしてそれが老化による脳機能の低下につながっているのではないか、と考えています」
老化だけでなく、ストレスのような他の種類の経験も、同じような変化をクロマチン構造に残しているのではないかと、現在研究を進めている。
今の脳科学では、ニューロン間の結びつき方や信号伝達の効率変化など、神経回路に記憶の主体があることが、すでに多くの研究で証明されている。岸准教授は、それとは異なる階層の記録を、クロマチン構造が担っているのではないかと考えている。
例えばストレス経験ならば、「いつ、誰にいやなことをされた」というような細かいエピソードの記憶は神経回路の役割だと考える(図2)。一方、クロマチン構造は遺伝子発現の応答性を変化させることで、神経回路の形成や機能を調整・変化させているのではないか。
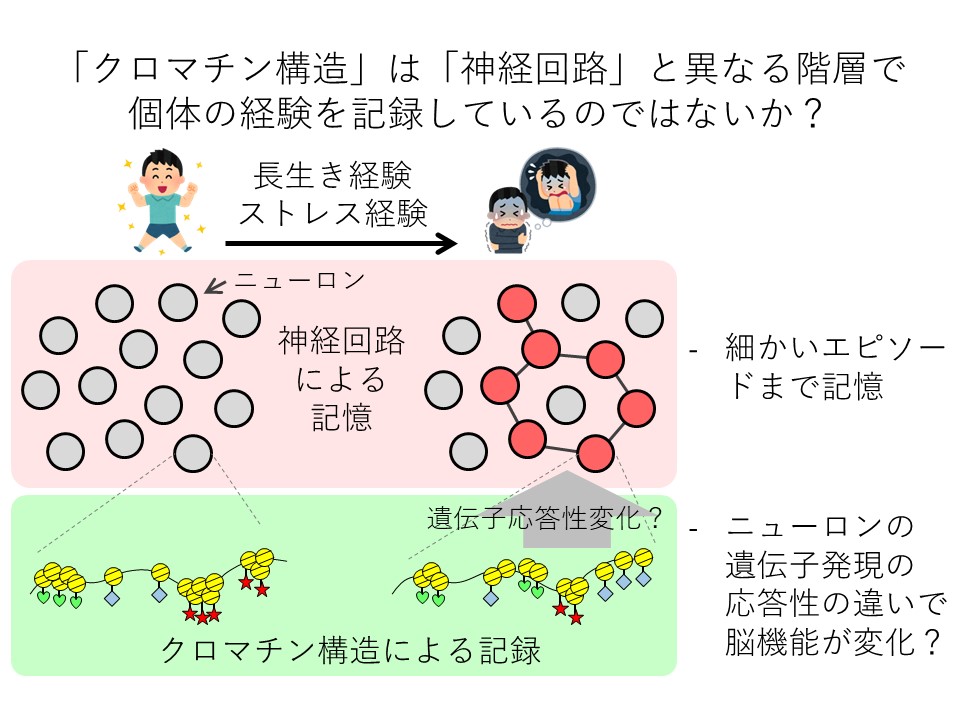
図2 クロマチン記録と神経回路の記憶との違い
「近年、クロマチン構造を人工的に編集できる技術が開発されています。それを応用すれば、老化、ストレスなどのクロマチン構造に書き込まれた記録を書き換えることで、脳機能を回復させる方法が見つかるかもしれません。老化した脳でも記憶力を取り戻したり、ストレスを受けた個体でもトラウマ的行動を示さなくするようにしたり、そういうことができるようになれば、という期待があります」
PAGSの支援なら「教えてもらいやすい」
岸准教授の研究では、クロマチン構造がどのような状態になっているか、どんな遺伝子を発現させているかなどを調べるのに、ゲノム解析の技術を駆使している。
最初のころは、先進ゲノム解析研究推進プラットフォーム(PAGS)の支援を担当している研究者にサンプルを渡して、解析まで全部支援してもらう形だった。
しかし、解析は自分でできるようにならないと、知りたいことが詳しく理解できない。そんなもどかしさがあり、いろいろ教えてもらっているうちに、他の研究者の解析をサポートできるまでになったという。

たとえば遺伝子の発現量をしらべるRNAシーケンシング解析では、最初はRNAを送るだけだった。「その試料をどう処理して、どういうふうに発現量を数値化しているか、やり方を教えてくださいとお願いしたら、すごく丁寧に一から教えてもらうことができました」
普通の共同研究では、独自の技術を提供してもらっている相手にどこまで尋ねていいのか、少し遠慮してしまう場合があるという。一方、PAGSならば、「支援してくれる先生と、支援を受ける生徒」のような関係性があるので、質問がしやすいと感じるそうだ。
そして、最新の技術を試したいという時にも、PAGSはとても力になってくれるという。たとえばシングルセル解析(1細胞ごとに全遺伝子の発現量を定量的に解析する)は威力のあるツールだが、当初は自分たちの研究システムにどう役立てることができて、またどういったメリット・デメリットがあるかは、実際にやってみないとわからない部分が残されていた。
PAGSに支援してもらえれば、その領域のプロフェッショナルがそろっているので、試料を処理する段階での失敗は減らせるし、データ解析もサポートしてもらえる。
これからPAGSの利用を検討している研究者には「何でも教えてもらえるので、あまりためらわずにとびこんでみると良いでしょう。この論文と同じ解析を、私も使ってみたいという形で伝えるのも一つの方法です」と助言する。
ただし、自分が何をやりたいのかはっきりさせていないと、せっかくのデータをうまく活用できずに終わってしまうことになりかねない。目的を具体的にすることも大事だともアドバイスしてくれている。
(2022年7月20日インタビュー)
*感染対策を行い、取材・撮影を行いました。
 岸 雄介(きし・ゆうすけ)
岸 雄介(きし・ゆうすけ)
東京大学 定量生命科学研究所 先端定量生命科学研究部門 分子神経生物学研究分野 准教授
神奈川県南足柄市出身。2005年3月 東京大学 工学部 化学生命工学科卒業。2010年 東京大学 大学院工学系研究科化学生命工学専攻 博士課程 単位取得卒業。2012年 工学博士。同年7月より、東京大学 分子細胞生物学研究所 (現定量生命科学研究所) 助教、東京大学大学院薬学系研究科 助教を経て、2017年7月より東京大学 大学院薬学系研究科 講師。2022年8月より現職。
支援利用者インタビュー
【イベントお知らせ】📢先進ゲノム支援プラットフォームが情報解析講習会(中級)を開催します!
— 生命科学連携推進協議会 (@platform_imsut) January 29, 2026
◇日時:2/20(金)10:00~16:00 (Zoom)
◇参加費無料
※ご参加には受講登録が必要です。
登録締め切り🔔【 2/9(月)】
ご登録・詳細はこちら▶️https://t.co/noZxGChOB1 https://t.co/TQO8qrM3HH







