B. これまでの成果と今後の展望
4. ALSの特異マーカーとの関連
(ア) TDP-43病理:ALS患者脊髄運動ニューロンにみられる神経病理学的指標
- ① TDP-43病理:本来は核に局在するRNA結合タンパクであるTDP-43が、ALSの運動ニューロンでは核から喪失し、細胞質に異常な封入体が形成されている。しかも、TDP-43は異常な断片化、リン酸化を受けている。
- ② 大多数の孤発性ALS、一部の遺伝性ALS患者で運動ニューロンにTDP-43病理が観察されることから、ALSの神経病理学的指標となっている。
- ③ 孤発性ALS運動ニューロンでは、TDP-43陽性封入体の出現とADAR2の免疫活性消失とが同一の運動ニューロンに生じており、TDP-43陽性封入体を持たない運動ニューロンではADAR2免疫活性が保たれている19。
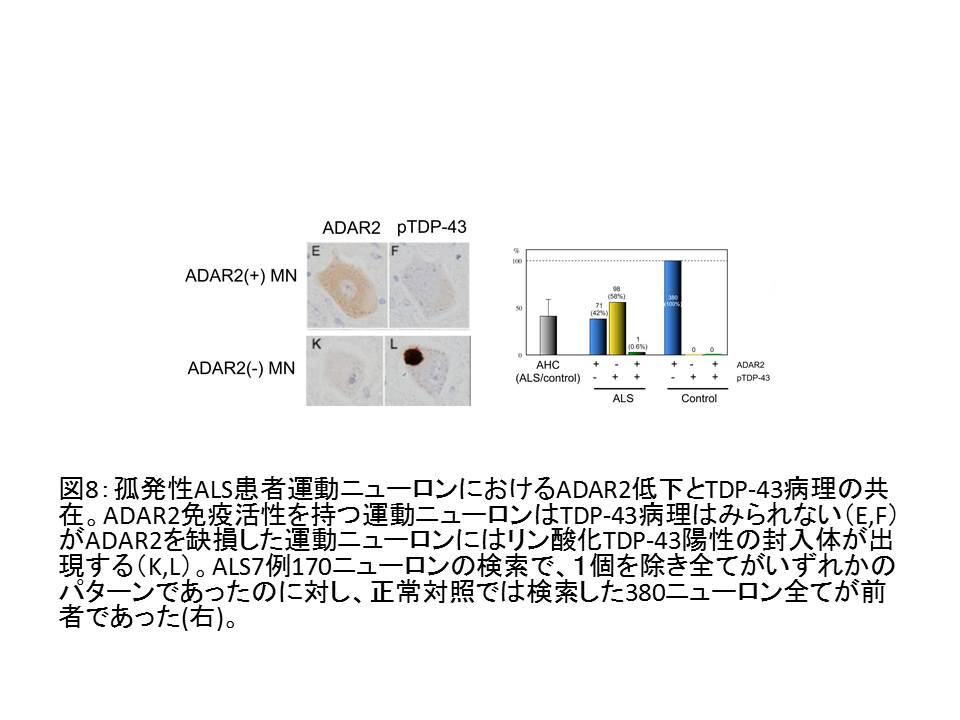 図8
図8
- ④ すなわちTDP-43病理の出現メカニズムとADAR2が低下するメカニズムの間には何らかの連関がある19。
(イ) 分子病態モデルマウス(AR2マウス)における所見
- ① ADAR2低下とTDP-43病理の分子連関の検討を行い、ADAR2活性低下がTDP-43病理を引き起こすことを明らかにした。
- 1. 培養細胞での検討からTDP-43の断片化、過剰発現、ノックダウンによる減少、変異TDP-43の発現は、何れも培養細胞のADAR2 発現低下を引き起こさない20。
- 2. 分子病態モデルマウス(AR2マウス)のADAR2 を欠損した運動ニューロンでTDP-43病理類似の細胞内局在異常が観察される 21。
- 3. そのメカニズムは、AMPA受容体から流入した過剰なカルシウムがタンパク分解酵素であるカルパインを活性化し、TDP-43を凝集しやすい断片に切断することであることを証明した21。
- ② カルパイン断片に相同の断片がALS患者剖検脳・脊髄にも検出された21ことは、ALSの運動ニューロンでも同様のメカニズムによりADAR2 活性低下がTDP-43病理を引き起こしている可能性を示唆する。
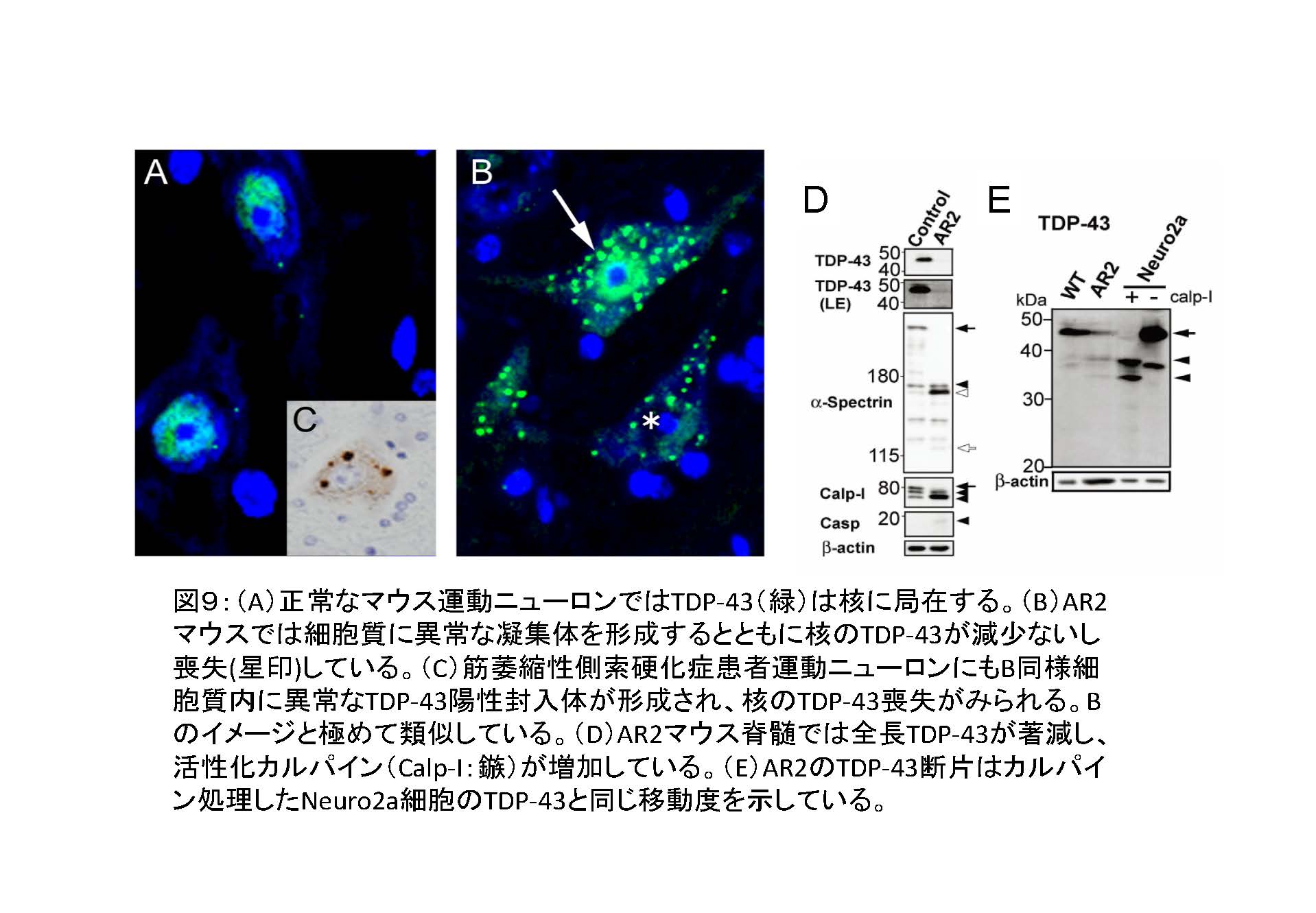 図9
図9
(ウ) ADAR2 活性低下に依りTDP-43病理が形成されるメカニズム
- ① ADAR2 発現低下 → Q/R 部位未編集型GluA2の発現→Ca2+透過性AMPA受容体の発現 → 細胞内Ca2+濃度の上昇 → Ca2+依存性プロテアーゼであるカルパインの活性化 → TDP-43の断片化→断片の凝集性昂進による凝集塊・封入体形成 → 核と細胞質をシャトルするTDP-43の封入体への巻き込み → 核からのTDP-43の喪失。
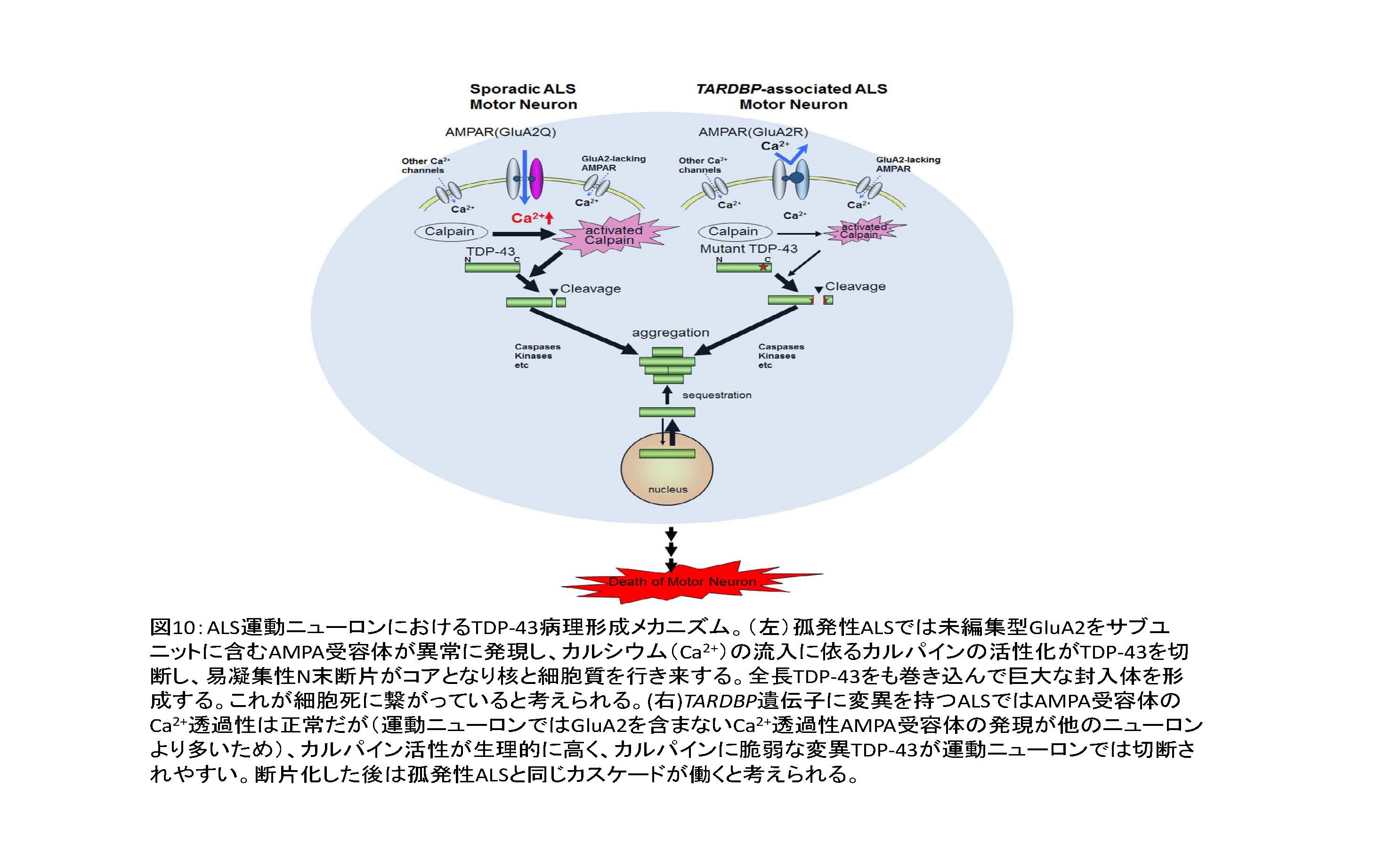 図10
図10
(エ) 孤発性ALS以外のTDP-43病理
- ① 一部の遺伝性ALSの運動ニューロンにもTDP-43病理が観察される。
- 1. TARDBP(TDP-43をコードする遺伝子)関連ALS
- 2. C90RF72関連ALS
- ② 大脳皮質や海馬ニューロンなどにTDP-43病理が観察される
- 1. 前頭側頭葉変性症、アルツハイマー病、拳闘家脳症など
- 2. 正常高齢者
(オ) TDP-43病理の形成にはカルパインが中心的に関與していることが明らかになったので、これら孤発性ALSのTDP-43病理形成にどのようにカルパインが関わるかが今後の検討の対象になる
- ① カルパインの活性化は細胞内Ca2+濃度の上昇によるので、複数の細胞内Ca2+濃度を高めるシステムのどれが働くかにより、異なったメカニズムでカルパインが活性化しうる。
- 1. NMDA受容体、Ca2+チャネルなど細胞外からの流入
- 2. ミトコンドリアや小胞体など細胞内のCa2+貯蔵庫からの放出
- ② カルパイン活性が高すぎると、易凝集性TDP-43断片はより小さい可溶性の断片に切断される。
- 1. TDP-43病理の形成には、ほどよいカルパインの活性が持続する細胞内環境が必要
- 2. 脳虚血や脳外傷ではNMDA受容体などからの大量のCa2+流入があり、しかも一過性なので、TDP-43の局在異常が一過性であり、封入体形成を伴わない21。
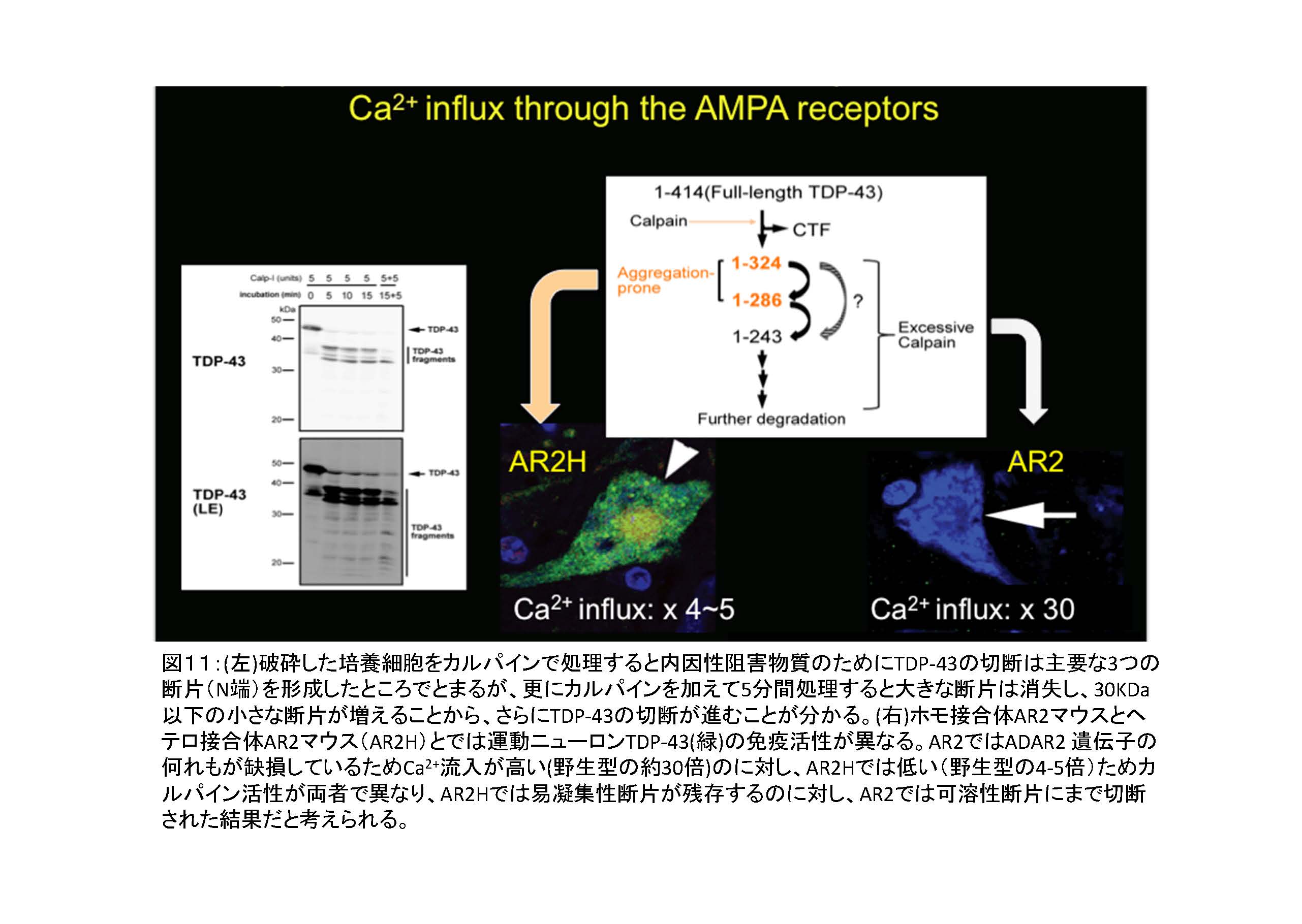 図11
図11
- 3. TDP-43のリン酸化はカルパインによる切断活性への抵抗性を増強する22。
(カ) カルパインの活性化以外に、TDP-43のカルパインへの脆弱性が増すことによっても、易凝集性断片が生じうる。
- ① TARDBP(TDP-43をコードする遺伝子)に変異のあるALSは、変異TDP-43がカルパインに切れやすくなることにより起こる。
- ② 運動ニューロンにはAMPA受容体のカルシウム透過性を決定するGluA2の発現が他のニューロンに比べ低いため、GluA2をサブユニットにもたないAMPA受容体、すなわちCa2+透過性AMPA受容体の発現が多く、活性型カルパインの発現も多いことがTARDBPの変異がALSとして現れる理由であろう22。
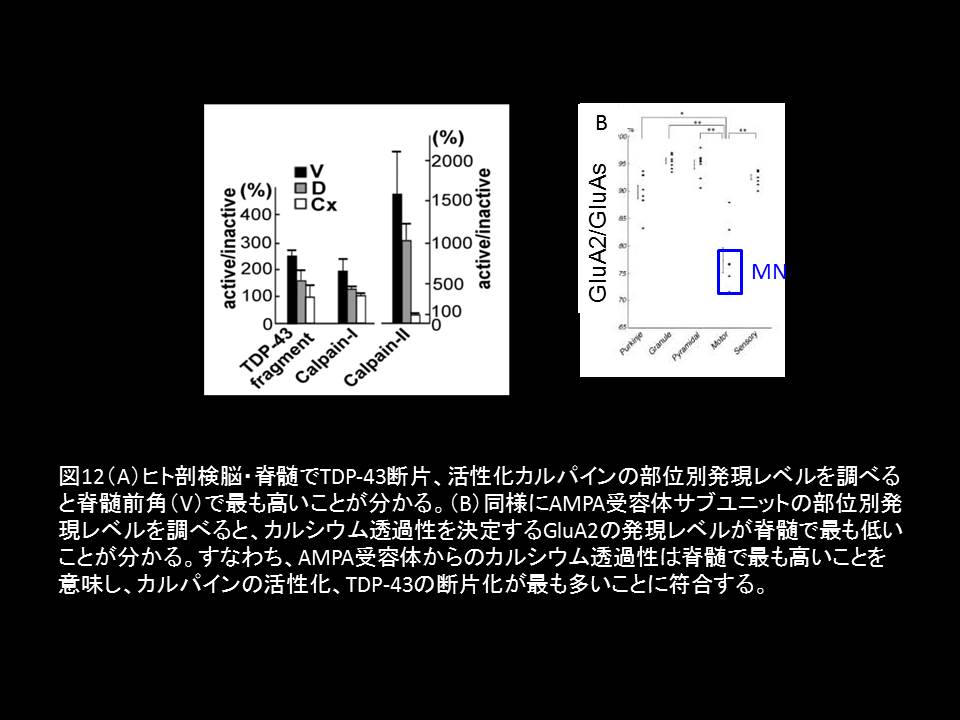 図12
図12
(キ) カルパインの活性化とTDP-43病理形成との関連は、超高齢マウス運動ニューロンにも生じている。
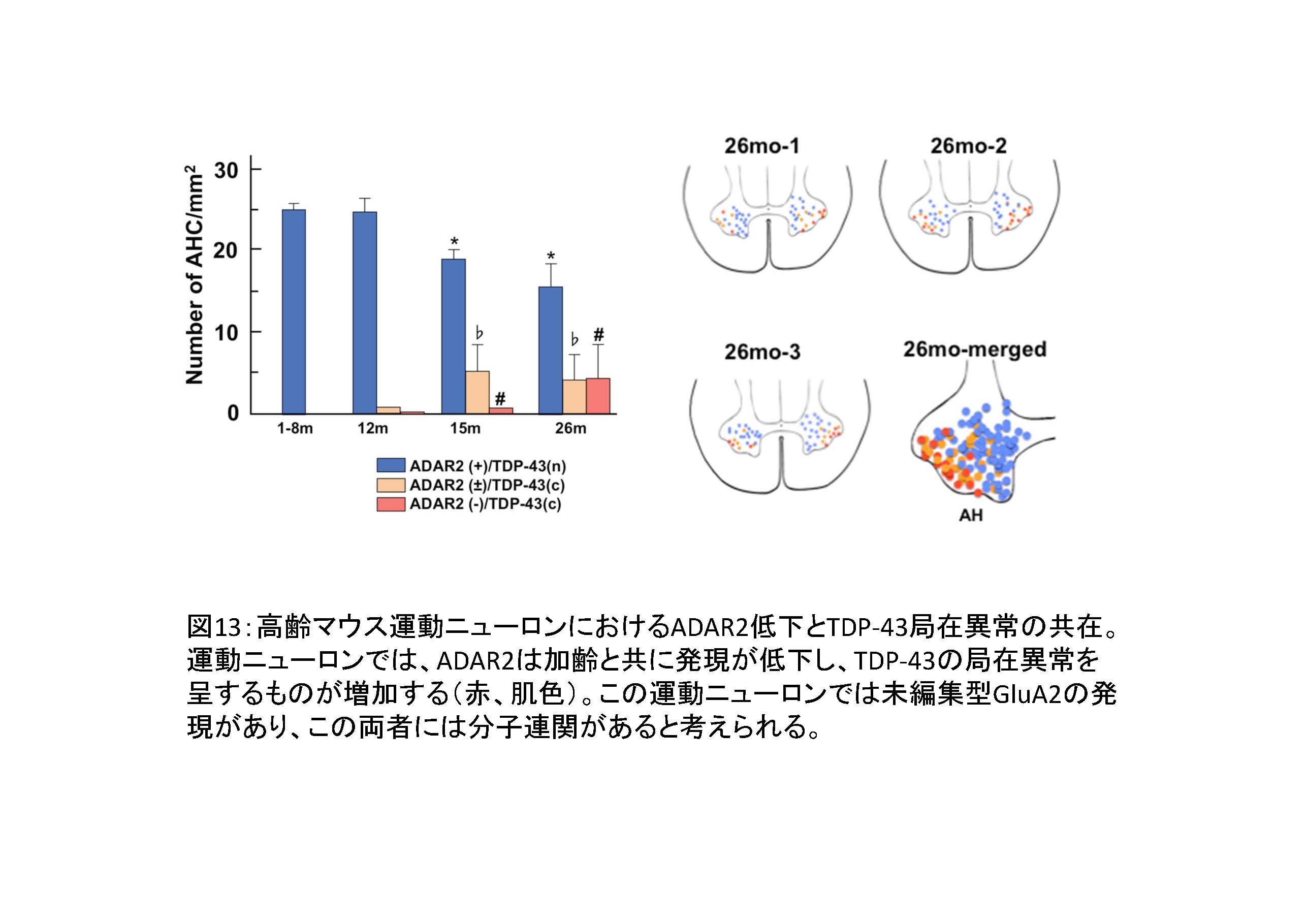 図13
図13
- ① 加齢と共に運動ニューロン脱落が生ずること、加齢がALSの危険因子であることはよく知られており、その理由はよくわかっていなかった。
- ② 運動ニューロン(特にFast fatigable motor neuron)では加齢性にADAR2の発現が低下する23。加齢がALSの危険因子であることの分子基盤であると考えるとこの現象をよく説明できる。
- ③ 加齢は神経変性疾患の危険因子であることが多い。運動ニューロン以外でも加齢と共にTDP-43病理が観察されるようになるので、加齢依存性の細胞内Ca2+上昇がさまざまな神経疾患に病因的意義を持つ可能性がある。