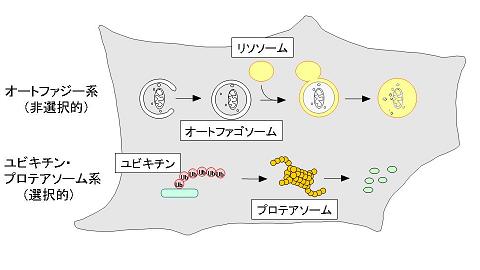
(上段)オートファジーではまず細胞質の一部が隔離膜によって取り囲まれてオートファゴソームが形成される。次にオートファゴソームの外膜とリソソーム膜との融合によってオートリソソームとなり、内容物が分解される。
(下段)ユビキチン・プロテアソーム系では、ユビキチン鎖で標識された基質が、プロテアソームによって分解される。これは厳密な認識機構をもった選択的タンパク質分解系である。
| オートファジー(自食作用) |
 |
| 図1 真核生物の主要な細胞内分解機構 (上段)オートファジーではまず細胞質の一部が隔離膜によって取り囲まれてオートファゴソームが形成される。次にオートファゴソームの外膜とリソソーム膜との融合によってオートリソソームとなり、内容物が分解される。 (下段)ユビキチン・プロテアソーム系では、ユビキチン鎖で標識された基質が、プロテアソームによって分解される。これは厳密な認識機構をもった選択的タンパク質分解系である。 |
| これまでの研究成果 |
 |
|
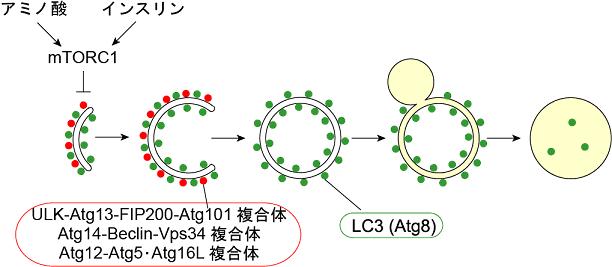
図2 哺乳類細胞でのオートファゴソーム形成の模式図 Atg12-Atg5共有結合体、Atg16Lを含む800 kD複合体は隔離膜に局在し、オートファゴソームへの成長に必須な働きをする。隔離膜が閉じてオートファゴソームとなるとAtg12-Atg5は膜から離脱し、その後外膜に存在するLC3(Atg8ホモログ)も徐々に離脱する。 |
 |
|
図3 Atg5-/-ES細胞はオートファジー不能となる 血清アミノ酸飢餓2時間のES細胞の電子顕微鏡像。バー:1μm。(長浜バイオ大学山本章嗣教授による)。 |
 |
|
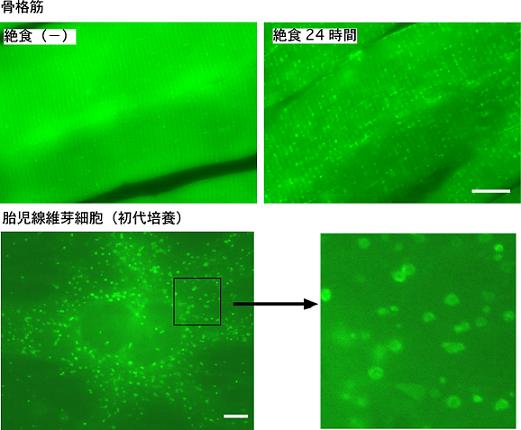
図4 GFP-LC3トランスジェニックマウスを用いた観察例 (上段)骨格筋(腓腹筋)では飽食時はほとんどオートファジーがおこっていないが、24時間の絶食によって著明にオートファジーが誘導される。小さな輝点がオートファゴソームを示す。 (下段)胎児線維芽細胞の初代培養。アミノ酸血清飢餓2時間。バー:10μm。 |
| 当研究室の課題 |
| ・非選択性(バルク) ・誘導性 |
 |
|
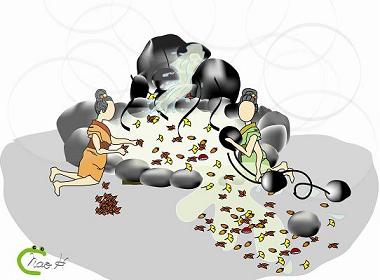
図6 オートファジーとユビキチン・プロテアソーム系の温泉モデル ユビキチン・プロテアソーム系はゴミを個別に認識する(左)。一方、オートファジーは基本的には個別な識別をせずに、ゴミとともに湯も捨て、新しい湯を入れることで新鮮さを保つ(右)。一見無駄に思える方法でも、効率はよいと考えられる(画・細川) |
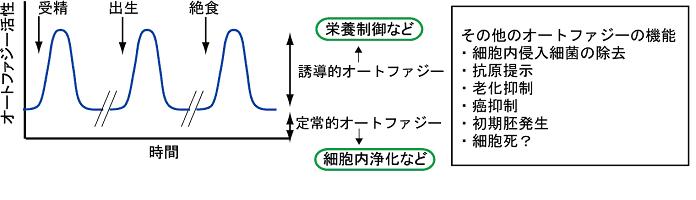
| ・基底レベルのオートファジー 〜細胞の健康をたもつ〜 ・誘導されるオートファジー 〜飢餓などの変化に対応する〜 |
 |
|
図7 誘導的オートファジーと恒常的オートファジー
|
TOPへ戻る