
 |
 |
 |
 |
 |
 |
 |
現在、国内外でCADASIL患者さんの細胞から樹立したiPS細胞(※1)や、NOTCH3遺伝子改変マウス(※2)などを用いて、CADASILの 病態研究が進められています。
※1 iPS細胞とは? |
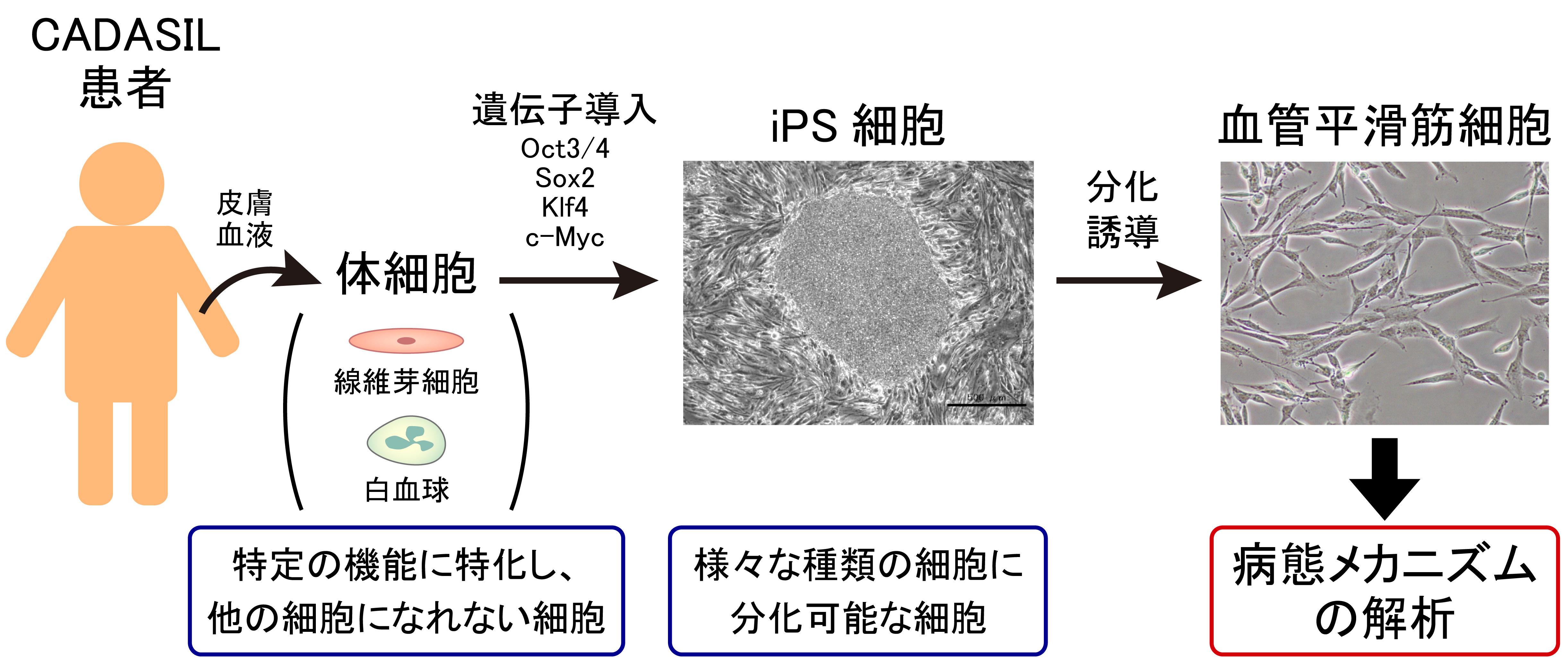
|
※2遺伝子改変マウスとは? |
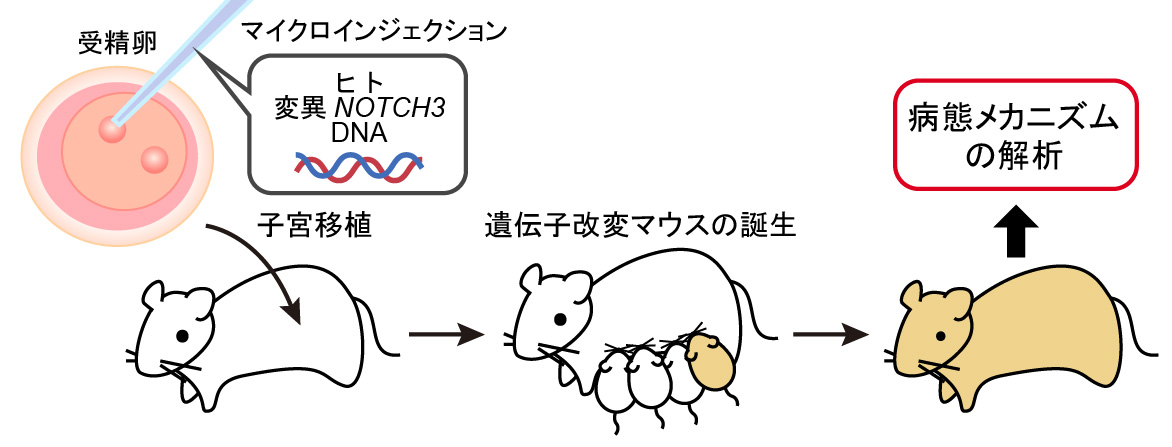
|
遺伝性脳小血管病CADASILの患者さんのiPS細胞を作成し、発症メカニズムの解明が行われています。 iPS細胞を血管平滑筋に分化させ、様々な細胞機能を正常な細胞と比較することで、遺伝子変異が細胞に及ぼす影響を知ることができます。 CADASILの症状の原因となる分子メカニズムがわかれば、治療薬の開発に一歩踏み出すことができます。
血管平滑筋に分化誘導したところ、細胞骨格の異常や細胞増殖の亢進が見られた。また、炎症反応に関係するNF-κB シグナル経路の活性化がCADASILの病態メカニズムに関係している可能性が示唆された。
Ling, C. et al. Protein & Cell. 2019;10:249-271.患者iPS細胞から分化誘導した血管平滑筋では、血管の発達や新しい血管を作る過程に関わるPDGFRβやVEGFなどが減少 し、低酸素ストレスに弱くなっている可能性が示唆された。
Kelleher, J. et al. Stem cell reports. 2019;13:817-831.患者iPS細胞から分化誘導した血管平滑筋において、これまでに臨床研究や基礎研究で報告されている、 アクチン細胞骨格の異常、PDGFRβの増加、GOMの沈着などを再現した。また、血管の発達に関わるPDGFRβの増加がCADASILの病態メカニズム に関わる可能性を示した。
Yamamoto, Y. et al. Molecular Brain. 2020;13:38.CADASILの変異をもつヒトNOTCH3遺伝子をマウスの血管平滑筋細胞に特異的に発現させたマウスが作成されて います。マウスは、脳の解剖学的にも寿命的にもヒトと大きく異なるため、完全にヒトでのCADASILの病態を再現するには至っていません。 しかし、加齢に伴い、血管壁が厚くなる病変や、GOMの沈着などの血管の異常は確認されており、一部のNOTCH3遺伝子改変マウスでは、 白質障害も再現されています。
R90C変異を持つ遺伝子改変マウスにおいて、加齢に伴う血管平滑筋細胞の変性や、GOM、Notch3の凝集などが確認された。 血管平滑筋細胞の異常は、GOMやNotch3細胞外ドメインの血管壁への沈着に先行して起こっていた。 また、血流依存性の血管拡張能の低下と血圧依存性の血管収縮能の増強が確認された。
Ruchoux, M.M. et al. Am J Pathol. 2003;162:329-342.R169C変異を持つ遺伝子改変マウスにおいて、CADASIL患者でみられるものと類似の白質病変が再現された。
Cognat, E.et al. Acta Neuropathol Commun. 2014;2:49.マウスの内在性Notch3を欠損しているマウスで、C455R変異またはR1031C変異をもつ遺伝子改変マウスを作成した。 C445R変異が機能欠失変異(そのタンパク質の本来の機能を失う遺伝子変異)である一方、R1031C変異は活性低下変異である可能性が示唆された。 どちらの遺伝子改変マウスも、血管平滑筋の変性や血管壁へのGOMの沈着などの病変が確認されている。また、C455Rマウスでは、血漿中のHTRA1 (CARASIL※3の原因遺伝子から作られるタンパク質)が増加し、Notch3細胞外ドメインが減少していることを見出し、バイオマーカー として利用できる可能性が示された。
Arboleda-Velasquez, J.F.et al. Proc Natl Acad Sci U S A. 2011;108:E128-35. ※1 CARASIL
脳血管性認知症をおこす劣性遺伝疾患で、脳小血管病、若年性禿頭,変形性脊椎症を特徴とします。HTRA1
遺伝子の変異により、HTRA1タンパク質の活性がなくなる可能性が示唆されていますが、なぜCARASILでみられる病変を引き起こすかは分かっていません。