研究の紹介
自然免疫細胞におけるシグナリングエンドソームの役割と機能
古くよりエンドソーム・リソソームは物質分解を担うオルガネラと認識されてきたが、近年、物質の分解だけではなく、分泌やシグナル伝達の場として重要な役割を果たしていることが明らかになっている。エンドソームからリソソームにかけては、小胞輸送に伴って時間的・空間的に限局したシグナル伝達が可能となり、それによって細胞の分化、増殖、細胞運動など、多様な細胞応答が制御されている。病原体センサーとして生体防御に必須の役割を果たすToll様受容体 (TLR)の場合も、微生物や死細胞に由来する核酸を認識するTLR分子種では、エンドソームからリソソームにかかる小胞内でリガンドを結合し、シグナルを伝達する(図1)。
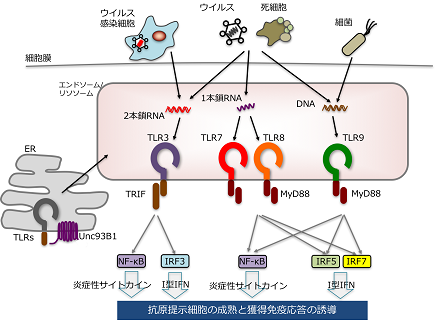
図1 核酸認識TLRのリガンドとシグナル
私たちの研究室では、酸性化や小胞輸送に伴って、ダイナミックに配置と環境が変化するこれらの空間でどのようにシグナルが制御され、多彩な炎症応答が媒介されるのか?という視点から、エンドソーム/リソソームの環境に依存した炎症応答制御機構の解明に取り組んでいる。
Solute carrier family 15A4(SLC15A4)は免疫細胞に優先して発現する後期エンドソーム・リソソーム局在型アミノ酸トランスポーターで、プロトンと共役してヒスチジンおよびヒスチジンを含む短鎖ペプチドを小胞内腔から細胞質へと輸送している(図2)。
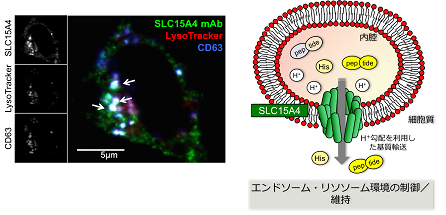
図2 SLC15A4の細胞内局在と機能モデル
SLC15A4はヒトの全身性エリテマトーデス(SLE)、糖尿病、関節リウマチ、炎症性腸疾患において、疾患関連遺伝子として報告がなされているが、病態形成における役割については不明な点が多い。私たちはこれまでに、SLC15A4がプラズマ樹状細胞におけるTLR7/9シグナルに依存したI型インターフェロン (IFN-I)および炎症性サイトカイン産生に必須であること、細胞質病原体センサーであるNOD1のリガンドをリソソームから細胞質へ輸送する責任分子であること、腸炎の病態形成に重要な役割を果たしていること (Sasawatari S, et al. Gastroenterology 2011)を明らかにしてきた。さらに、SLC15A4とSLEとの関連に着目し、マウスループスモデルを用いてSLC15A4が媒介するIFN-I産生調節機構と自己抗体産生のメカニズムを明らかにし、この分子がリソソーム内ヒスチジン量とプロトン量を制御することによって、リソソームにおけるmTOR経路の活性化を媒介していることを見いだした(Kobayashi T, et al. Immunity 2014, 図3)。
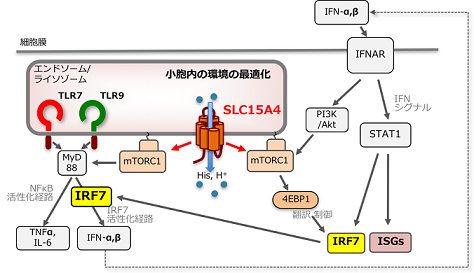
図3 SLC15A4によるTLR7/TLR9シグナルの制御
この研究においてとりわけ強調すべき成果は、エンドソーム・リソソーム内の物質環境の適切なコントロールが、シグナル伝達のハブとしてのエンドソーム・リソソームの機能および炎症応答制御に極めて重要であるという新たな概念をもたらしたという点にある。さらに最近では、炎症メディエーターなどの分泌に特化したリソソームを持つマスト細胞の応答をSLC15A4が媒介することを発見し(Kobayashi T, et al. 未公表)、エンドソーム・リソソームの機能制御がアレルギー炎症応答においても重要であることを示している。
近年、リソソーム膜に局在するアミノ酸トランスポーターSLC38A9 が、mTORC の活性を制御しているという報告がなされている(Rebsamen M et al. Nature 2015, Wang S et al. Science 2015)。 SLC15A4、SLC38A9 ともにエンドソーム/リソソーム内から細胞質にアミノ酸という基質を輸送すること、また酸性pHでトランスポーター活性が上昇することも示されている。一方で、SLC38A9がNa+勾配を利用して主にアルギニンを輸送するのに対し、SLC15A4はプロトン勾配を利用してヒスチジンあるいはオリゴペプチドを輸送することなど、基質と作用機序に違いがある。 SLC38A9によるTLRシグナルの制御については未だ報告されていないが、アミノ酸輸送を介して mTORC1の活性を制御するというSLC15A4と共通の機能を有し、また輸送基質と作用機序の違いから、これらのトランスポーターがそれぞれmTORC1 活性を制御する空間やタイミングを異にしている可能性がある。こうしたアミノ酸トランスポーターがエンドソーム・リソソームを介した炎症シグナルを制御する機構の解明は、これまで漠然と理解されていた細胞内の環境が調節する細胞機能・応答について具体的な答えを与えてくれるものと考えている。
