研究の紹介
自然免疫細胞におけるシグナリングエンドソームの役割と機能
古くよりエンドソーム・リソソームは物質分解を担うオルガネラと認識されてきましたが、近年、物質の分解だけではなく、分泌やシグナル伝達の場として重要な役割を果たしていることが明らかになっています。受容体からのシグナル伝達は、刺激を受けた場所(多くは細胞表面)だけでなく、受容体がエンドソームからリソソームへ輸送される間にも起こることが知られ、この時間的・空間的に限局された細胞内小胞でのシグナル伝達が細胞の分化、増殖、細胞運動など、多様な細胞応答の制御に重要な役目を果たしています。
病原体センサーとして生体防御に必須の役割を果たすToll様受容体 (TLR)の場合も、微生物や死細胞に由来する核酸を認識するTLR分子種(TLR3, TLR7, TLR8, TLR9)では、後期エンドソームからリソソームにかかる小胞内でリガンドと出会い、認識し、シグナル伝達を行っています(図1)。エンドソームの酸性化は特に重要な因子で、薬剤により酸性化を阻害するとこれらTLRのリガンド認識に異常をきたし、応答が減弱することが知られています(Barton GM & Kagan JC, Nat Rev Immunol 2009)。
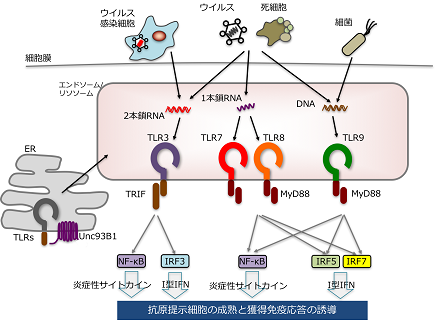
図1 核酸認識TLRのリガンドとシグナル
ウイルスや死細胞などから遊離したDNAやRNAといった核酸は、細胞のエンドソーム・リソソーム内に取り込まれ、そこに局在するTLR3, TLR7, TLR8, TLR9によって認識される。TLRからはMyD88やTRIFといったアダプター分子を介してNF-κBやI型IFNを誘導するシグナルが伝達される。
私たちの研究室では、酸性化や小胞輸送に伴って、ダイナミックに配置と環境が変化するこれらの空間でどのようにシグナルが制御され、多彩な炎症応答が媒介されるのか?という視点から、エンドソーム/リソソームの環境に依存した炎症応答制御機構の解明に取り組んでいます。
その中でも、私たちはSolute carrier family 15A4(SLC15A4)という免疫細胞に優先して発現する後期エンドソーム・リソソーム局在型アミノ酸トランスポーターに着目してTLR応答におけるこのトランスポーターの役割を解析し、炎症応答におけるエンドソーム・リソソーム内環境制御の重要性、またその環境因子の同定を目指しています。
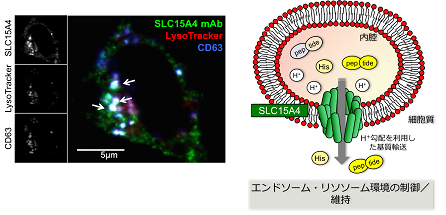
図2 SLC15A4の細胞内局在と機能モデル
左)当研究室で樹立した抗SLC15A4抗体を用いて、マウスマスト細胞株P815を多重免疫染色した。LysoTrackerは酸性小胞、CD63は分泌顆粒のマーカーとして用いた。
右)SLC15A4はエンドソーム・リソソーム膜に局在し、プロトンの濃度勾配を利用して基質(アミノ酸、ペプチド)を内腔から細胞質へと輸送する。
SLC15A4はプロトンと共役してヒスチジンおよび短鎖ペプチドをエンドソーム・リソソームの小胞内腔から細胞質へと輸送している(図2)と考えられていますが、輸送の分子メカニズムや基質の全容についてはまだ明らかになっていません。また、SLC15A4遺伝子はヒトにおいて、全身性エリテマトーデス(SLE)、糖尿病、関節リウマチ、炎症性腸疾患の疾患関連遺伝子として多くの報告がありますが、病態形成における役割についても不明でした。私たちは、SLC15A4がプラズマ樹状細胞におけるTLR7/9シグナルに依存したI型インターフェロン (IFN-I)および炎症性サイトカイン産生に必須であること、細胞質病原体センサーであるNOD1のリガンドをリソソームから細胞質へ輸送する責任分子であること、炎症性腸疾患の病態形成に重要な役割を果たしていること (Sasawatari S, et al. Gastroenterology 2011)を明らかにしてきました。さらに、SLC15A4とSLEとの関連に着目し、マウスループスモデルを用いてSLC15A4が媒介するIFN-I産生調節機構と自己抗体産生のメカニズムを明らかにし、この分子がリソソーム内ヒスチジン量とプロトン量を制御することによって、リソソームにおけるmTOR経路の活性化を媒介していることを発見しました(Kobayashi T, et al. Immunity 2014, 図3)
また最近では、炎症メディエーターなどの分泌に特化したリソソームを持つマスト細胞の応答をSLC15A4が媒介することを発見し(Kobayashi T, et al. Int Immunol 2017)、エンドソーム・リソソームの機能制御がアレルギー炎症応答においても重要な役割を果たすことを明らかにしました。
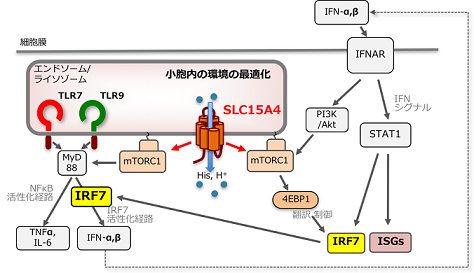
図3 SLC15A4によるTLR7/TLR9シグナルの制御
SLC15A4によるエンドソーム・リソソーム内環境の最適化は、TLR7/TLR9を介したmTORC1依存的なI型IFNの産生・増幅経路に重要な役割を果たしている。
これらの研究結果において特に強調したいのは、エンドソーム・リソソーム内の物質環境の適切なコントロールが、シグナル伝達のハブとしてのエンドソーム・リソソームの機能および炎症応答制御に極めて重要であるという新たな概念を導入したという点です。このことは、SLC15A4によるエンドソーム・リソソームの物質の出入りを人為的にコントロールできれば、SLEなどの炎症応答に起因する免疫疾患を制御できる可能性があることを意味しています。
近年、リソソーム膜に局在するアミノ酸トランスポーターSLC38A9 が、mTORC の活性を制御しているという報告がなされました(Rebsamen M et al. Nature 2015, Wang S et al. Science 2015) 。SLC15A4、SLC38A9 ともにエンドソーム/リソソーム内から細胞質にアミノ酸という基質を輸送すること、また酸性pHでトランスポーター活性が上昇することも示されていますが、一方で、SLC38A9がNa+勾配を利用して主にアルギニンを輸送するのに対し、SLC15A4はプロトン勾配を利用してヒスチジンあるいはオリゴペプチドを輸送することなど、基質と作用機序に違いがあります。 SLC38A9によるTLRシグナルの制御については(2018年1月時点)未だ報告されていませんが、アミノ酸輸送を介して mTORC1の活性を制御するというSLC15A4と共通の機能を有するものの、輸送基質と作用機序の違いから、このトランスポーターがmTORC1依存的なTLR応答においてSLC15A4とは違なるシグナル伝達を媒介する可能性があります。
エンドソーム・リソソームを介した炎症シグナルの制御機構は未だ未知の部分が多く、こうした個々のアミノ酸トランスポーターの機能の解明を通じて、エンドソーム・リソソームで炎症時に何が起きているのか、その分子メカニズムの全容を明らかにすることが本プロジェクトの課題です。これまでブラックボックスだったリソソーム環境の調節機構とそれに依存する細胞機能・応答について、具体的な責任分子を同定することで、この分子をターゲットとする炎症応答の制御法を開発することが可能となり、炎症性疾患に対する新たな治療標的の可能性を切り開くことができると考えています。
