尾崎 紀夫(名古屋大学・大学院医学系研究科・精神医学・親と子どもの心療学分野・教授)

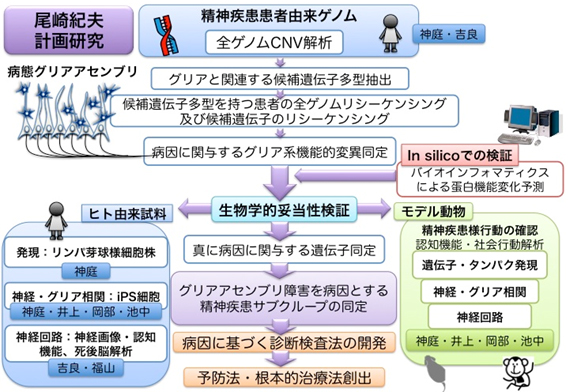
精神疾患(統合失調症、双極性障害、自閉症スペクトラム障がい)の臨床的課題を解決するためには、精神症候学に基づく現在の診断分類を、病因に基づいて再構築して、病因に基づく検査法や治療法を開発する必要があります。精神疾患の諸症状は、脳の各領域間の連携不全に起因すると想定されており、脳領域の連携ネットワークを担っている白質・ミエリンの障害が関与する可能性が示唆されるなど、精神疾患の一部は、グリアアセンブリの機能不全に起因する疾患、グリア病であると考えられます。実際、我々は、Common Disease-Rare Variant (CD-RV)仮説に基づいた全ゲノムコピー数変異(CNV)探索およびリシークエンスを実施し、グリア関連遺伝子が精神疾患と関連する証左を得ています。
本計画研究では、精神疾患の包括的ゲノム解析により得られた疾患関連遺伝子変異を、患者由来試料とモデル動物を用いて検証し、グリアアセンブリの障害に病因を有する精神疾患サブグループ同定を目指します。
1) CD-RV仮説に則った多様な精神神経疾患の全ゲノム解析を基点として(神庭、吉良と連携)、頻度は低いが、精神疾患の病因に強く関与するグリア関連遺伝子変異を同定し、さらに蛋白質機能にどの様な影響を与えるかをin silicoで予測した上で、以下の方法で、ゲノム解析の結果の生物学的妥当性を検証します。
2) ヒト由来試料:死後脳解析(吉良と連携)・神経画像解析(福山と連携)・リンパ芽球様細胞株を対象とした網羅的発現解析(神庭と連携)、iPS細胞を用いた神経・グリア相関の解析(神庭、井上、岡部、池中と連携)により検証します。
3) げっ歯類・霊長類モデル動物(神庭、井上、岡部、池中と連携):行動解析、遺伝子発現解析、神経・グリア相関解析、神経回路解析により検証します。
以上により、グリアアセンブリ障害を病因とする精神疾患サブグループを同定することで、病因に基づく診断検査法の開発、予防法・根本的治療法の開発につなげます。
井上 和秀(九州大学大学院・薬学研究院・薬理学分野・教授)

私達は、神経損傷により活性化した脊髄後角ミクログリアが、近接するニューロンの機能異常を誘発させ難治性慢性疼痛を発症させることを発見しました(Nature 2003, 20005)。
一方、慢性疼痛には「情動」も大きく影響し、痛みを慢性化する重要な要因として情動系脳領域の発達障害が挙げられています。
事実、慢性疼痛患者ではパニック障害や外傷性ストレス障害の発生率が高く、慢性疼痛と精神疾患が併存している率が高いことが明らかになっています。しかし、慢性疼痛と中枢領域発達障害の関連性については不明です。そこで本研究では、発達障害モデル動物の中枢内ミクログリアの異常がもたらすシナプスの形成・維持・剪定ににおける変化,疼痛を慢性化へ導くメカニズムを明らかにし、また、発達期シナプスリモデリングに重要なミクログリアの突起運動および細胞貪食などとシナプス回路制御様式との関係をつぎのように明らかにします。
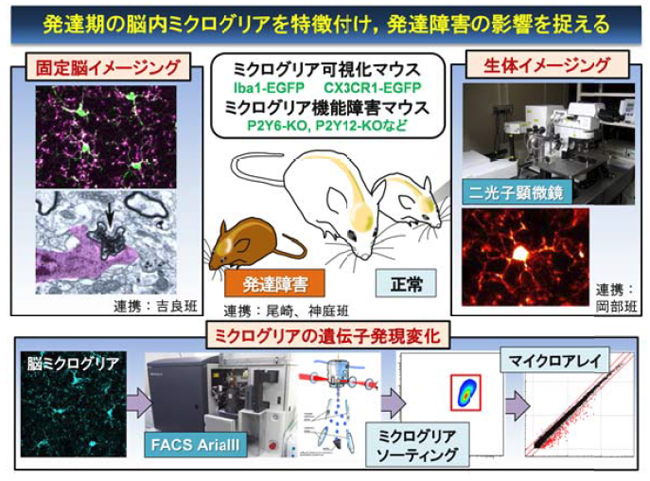
(1)発達期における中枢内ミクログリアの特徴
発達期シナプスリモデリングに重要と考えられるミクログリアの突起運動および細胞貪食などを、中枢領域(特に前頭前野、前帯状回、一次体性感覚野、脊髄など)にてミクログリア蛍光標識マウス(Iba1-EGFPマウスや CX3CR1-EGFPマウス)と二光子励起顕微鏡を用いて、脳スライスおよび in vivoレベルでイメージングし、発達期と成熟期で比較する。ミクログリアの形態は、灌流固定した脳切片を用い免疫組織染色により検討する。
また、ミクログリアの突起運動と細胞貪食の機能制御に重要なP2Y12やP2Y6(Nature 2007)欠損マウスでも同様に解析する。
(2)発達障害モデルにおける中枢内ミクログリアの機能変化
発達障害モデルとして、ミクログリア蛍光標識マウスを用いて幼弱期隔離や繰返し社会的ストレス負荷を施し、ミクログリアの形態変化、突起運動および細胞貪食をin vivoイメージングで長期的に観察して臨界期から成熟期までの変動を明らかにする。
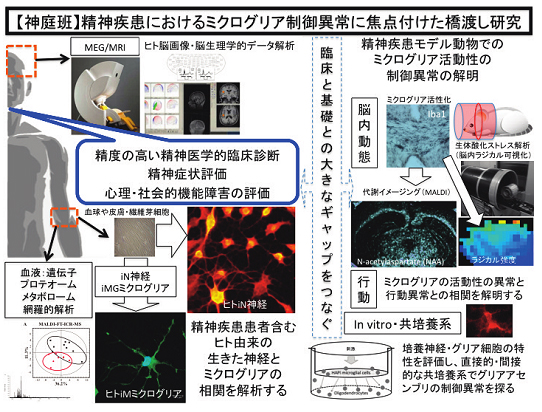
神庭 重信(九州大学大学院医学研究院 精神病態医学・教授)

私たちは、過剰活性化などミクログリアの異常制御が白質ミエリン障害・シナプス伝達異常を引き起こし統合失調症など精神疾患の病態を引き起こすという仮説を立て、動物由来ミクログリア・オリゴデンドロサイト・神経、及び、ヒト体細胞由来遺伝子誘導神経・ミクログリアを用いた細胞間のクロストーク異常の解析とその抗精神病薬の影響を測定し、さらに、統合失調症関連モデル動物を用いたin vivoでの解析を組み合わせ、精神疾患におけるミクログリア制御異常の機構を探ります。
1)齧歯類由来ミクログリア(初代培養・細胞株)とオリゴデンドロサイト・神経との共培養システムを樹立し、ミクログリア活性化がオリゴデンドロサイト・神経シナプスへ与える影響を測定し、その抗精神病薬の影響を解析します。
2)ヒト由来の生体試料(皮膚線維芽細胞など)から、神経及びミクログリアを遺伝子改変技術にて作成し、その神経とミクログリアの特性を評価します。同時に、脳画像データ(MRI, DTI)、脳波・MEGデータ、精神機能評価(PANSS, BACS-Jなど)、を集積し、ヒト由来細胞のデータとの相関を解析することで、in vitroレベルの反応と脳形態変化、および、精神機能との相関を解明し、ミクログリアや神経が精神機能に果たす役割を探っていきます。
3)モデルマウスを用いて、ミクログリア異常活性化などミクログリアの異常制御が白質障害・神経シナプス異常を引き起こす特異的なプロセスを解析します。
3-1)行動変容を行動薬理学的実験にて解析、
3-2)白質障害や神経シナプス異常の同定を行う、
3-3)オーバーハウザーMRI (OMRI) を用いて、ミクログリア由来の生体酸化ストレス動態を計測、
3-4)同時に、微小透析法にて、脳内物質の動態を検索、
3-5)MALDIイメージング法を用いて、Glutamateなど脳内代謝動態を解析、
3-6)二光子in vivoイメージングによるミクログリアを可視化し、シナプスとのコンタクトや異常刈り込み現象を捉え、その疾患特異性を探ります。
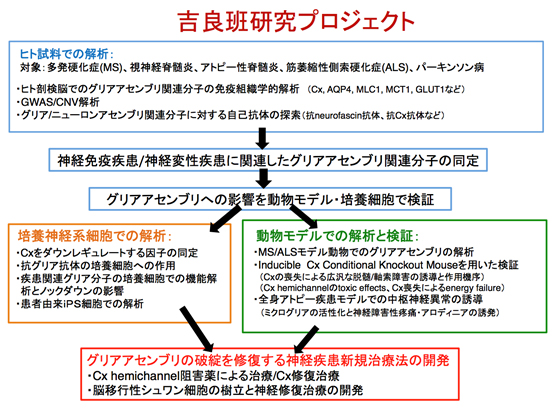
吉良 潤一(九州大学大学院医学研究院 神経内科学・教授)

グリア細胞とは、脳内の神経細胞(ニューロン)以外の実質細胞のことで、主にアストログリア、オリゴデンドログリア、ミクログリアが知られています。脳内では、神経細胞だけでなくこれらグリア細胞も、広範囲な脳領域をカバーする“グリアアセンブリ”と呼ぶにふさわしい巨大ネットワークを形成しています。一方で、視神経脊髄炎(NMO)や多発性硬化症(MS)など実際の患者では、アストログリアと他の細胞間の相互作用に異常が認められる事が明らかになりつつあります。さらに、統合失調症でも髄鞘の脱落や減少などが指摘され、少なくとも一部は髄鞘(オリゴ)-軸索(ニューロン)間の情報伝達異常が原因である可能性が指摘されています。
これらの疾患について、アストログリアとオリゴデンドログリア間およびグリアとニューロン・軸索間の連絡異常、即ちグリアアセンブリの機能不全により広汎な脱髄と軸索機能障害が生じるとの仮説を立てました。本研究では、グリアアセンブリの機能不全による疾患をグリア病と呼び、その病態解明と治療法の開発を行うことを目的とします。特にグリア細胞間の情報伝達窓口であるgap junctionを形成し細胞間コミュニケーションに極めて重要なコネキシン蛋白(Connexin(Cx))に着目して、白質機能異常を解明します。
そのために、1) 中枢性脱髄性疾患や統合失調症の多数例のヒト剖検脳脊髄標本を用いた分子免疫病理学的検討、2) 中枢神経炎症性病変におけるミクログリアの機能解析、3) 疾患モデル動物を用いた、各グリア細胞の遺伝子・蛋白群の発現変化の経時的な観察、ならびに培養細胞を用いた、Cx蛋白群や疾患関連遺伝子の発現に関する解析、4) 脱髄性疾患や統合失調症の疾患感受性に寄与する遺伝子の探索、さらに得られた疾患感受性遺伝子に関する、ヒト由来培養細胞を用いた検討、5) 間葉系細胞から誘導したシュワン細胞を用いた、中枢性脱髄疾患に対する画期的な移植治療法の開発、以上5項目の研究を行い、新たな診断、治療法の開発につなげます。