池中 一裕(自然科学研究機構・生理学研究所/岡崎統合バイオサイエンスセンター・教授)

グリアアセンブリはオリゴデンドロサイト(OL)/髄鞘を介して軸索上を伝搬する活動電位の伝導速度も調節しています。OL は多数の突起を伸ばし複数の軸索に髄鞘を形成するため、OL は軸索をグループ化して、伝導速度を調節している可能性があります。本研究ではこのOL を介した軸索間伝導速度調節不全が精神疾患との関連があるのではないかと考えて研究を進めます。まず、髄鞘-軸索連絡異常マウス(Neurofascin155 遺伝子のOL コンディショナルKO)およびマカクサル(Neurofascin155 遺伝子のレンチウイルスによるノックダウン)を作製し電気生理学的および行動解析を行い、ヒト精神疾患との関連を検討します。
また、OL が髄鞘を形成する軸索をどのように選択しているのかについても解析します。このために、OL から軸索ひいては神経細胞体まで染色する方法を開発します。髄鞘-軸索間に人為的なシナプス様構造を誘導し、狂犬病ウイルスにより逆行性標識可能かどうか検討します。具体的には下記の実験を行います。
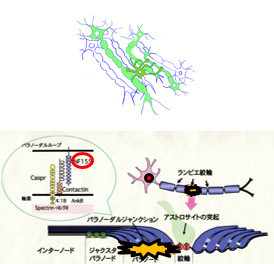
(1) OL による髄鞘形成軸索選別原理の解明OL にIL1RAcPb を発現させることにより髄鞘と軸索間にシナプス様構造を誘導し、狂犬病ウイルスを用いて一つのOL が髄鞘している軸索およびその細胞体を染色します。
(2) OL-軸索間相互作用破綻に起因する病態解明
パラノ-ダルジャンクション(PJ)のOL 側の主要構成成分NF155 を破壊することによりOL-軸索間相互作用欠失を誘導し、この変化に対応するマウス行動変化を観察します。さらにマカクサル内包にNF155ノックダウンベクターを注入して行動変化を観察します。
山崎 良彦(山形大学医学部生理学講座 准教授)

オリゴデンドロサイトによって髄鞘化された神経軸索を主な構成要素とする白質は,その機能が正確で安定した情報伝達に寄与するのみであると考えられてきました。そのため、白質に関する研究の多くは、髄鞘化の機序や変性疾患における脱髄機序の解明といったものであり、情報伝達についての研究はあまり活発でなかったといえます。しかし、近年、視覚運動課題の修得後や成人になってからの言語獲得後に白質の容積が変化するという報告がなされており、白質が情報伝達において調節機能を有する可能性が示唆されています。
細胞レベルにおいても、オリゴデンドロサイト/髄鞘と軸索との間に活発な相互作用があることがわかり、我々もオリゴデンドロサイトが脱分極するとそれが髄鞘を形成している軸索の伝導速度が促進することを報告しました。これは、髄鞘形成後でもさらに伝導速度を速くする機構の存在を示しており、さらに活動電位の軸索伝導においてもシナプス可塑性のように短期的あるいは長期的な可塑的変化が起こる可能性を示唆しています。
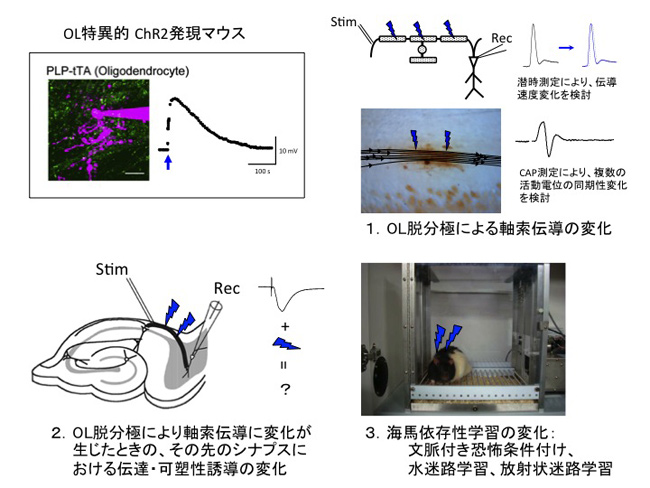
私たちの研究では、オリゴデンドロサイト特異的に光感受性チャネルを発現させたマウス(研究分担者 田中謙二が開発)を用いて複数のオリゴデンドロサイトを正確に操作し、これまでの電気生理学的実験の結果から想定される現象を、分子生物学的手法を用いた介入実験により検証し、その機序の解明によって確たるものにし、in vivo実験によって機能的意義を明らかにすることを目標とします。
具体的には、
(1)光刺激によってオリゴデンドロサイトを脱分極させたときの軸索伝導変化とその機序の検討
(2)オリゴデンドロサイト操作により軸索伝導が変化したときの出力先シナプスにおけるシナプス伝達および可塑性誘導の変化
(3)オリゴデンドロサイト操作による軸索伝導変化の生理的意義の解明-in vivoにおけるオリゴデンドロサイトの神経回路修飾効果の実証として、
・ CA1-海馬台シナプスにおける長期増強(特に後期長期増強)の検討
・ 海馬依存性の学習行動に及ぼす影響の検討
を行います。
飯野 正光(東京大学大学院医学系研究科・教授)

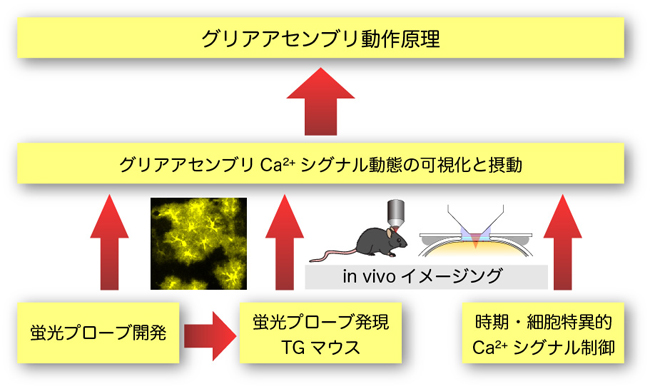
グリア細胞は大規模な細胞アセンブリを構成し、神経細胞や脳血管との情報交換を通じ、グリアアセンブリとしての動的機能構造を形成して脳機能発現を制御しています。しかし、グリアアセンブリの動作原理はまだ十分明らかになっていません。グリアアセンブリ内での情報処理には、化学伝達物質(ATP、グルタミン酸など)に関連した細胞内Ca2+シグナル機構が関与しています。従って、グリアアセンブリにおけるCa2+シグナルを高い時空間分解能で解析するとともに、それを人為的に操作することにより、機能構造の動作原理を明らかにできると考えられます。そこで、本研究では私たちがこれまでに蓄積したCa2+シグナル機構に関する先端的研究成果を基盤とした独創的な研究手法を適用して、この課題に挑みたいと考えています。
具体的には、グリア細胞特異的にCa2+プローブを発現するマウス、および部位時期特異的にCa2+シグナルを抑制できるマウスを作製するとともに、ATPおよびグルタミン酸プローブと二光子励起顕微鏡法を用いた生体内イメージング法を組み合わせ、グリアアセンブリにおける機能構造の動作原理を明らかにします。研究ステージ1では、アストロサイトアセンブリの動作原理解明を目指します。またステージ2では、オリゴデンドロサイトおよびミクログリアアセンブリに拡張したいと考えています。このような研究に際し、領域内の他の研究班との連携により成果を深めたいと考えています。
大木 研一(九州大学大学院・医学研究院・分子生理学分野・教授)

生体(in vivo)の脳で、グリアアセンブリ―とくにアストロサイトのネットワーク―がどのように神経細胞と相互作用し、神経活動の同期・非同期を制御しているかを解明することを目標とします。
グリア細胞の一種であるアストロサイトは、ギャップ結合やグリオトランスミッターによって相互に信号を伝えています。この信号伝達は、神経細胞間のような高速なデジタル的伝達ではなく、ゆっくりとしたアナログ的伝達で、伝達範囲は広範囲に及びます。このように、アストロサイトは、神経回路とは異なる様式で、自律的なネットワークを形成しています。さらに、アストロサイトは神経細胞間のシナプス伝達を調節していることが明らかになりつつあり、神経回路による情報処理を調節している可能性があります。
生体(in vivo)の脳でのグリア機能の解明は、始まったばかりです。グリア細胞は神経細胞と異なり活動電位を発生しないため、その活動を電気活動として観察することが難しく、生体の脳でどのように活動しているのか不明でした。近年、in vivo 2光子カルシウムイメージングの進歩により、アストロサイトの活動を生体の脳で調べることが可能になってきています。本研究では生体の脳でのアストロサイトがどのような脳機能を調節しているか、とくに神経細胞の活動の同期・非同期を含めた神経回路の動的特性、高次機能を含む多様な脳活動を、アストロサイトが調節している可能性を検証します。
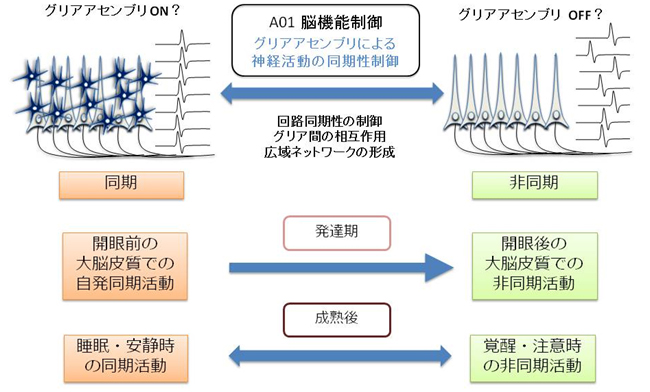
神経細胞の同期活動は、発達期と成熟後で様相が大きく異なります。発達期には、大脳皮質上を大域的な同期活動が伝播するのが見られ、大脳皮質の機能的成熟に役立っていると考えられます。一方、成熟後は、発達期のような遅い同期活動はおもに睡眠時に見られ、覚醒時には遅い同期活動は消失し、注意時には速い同期活動が亢進しています。本研究では、①発達期の大脳における同期活動の発生・伝播における、アストロサイトと神経細胞の相互作用を解明し、②アストロサイトと神経細胞の相互作用が、神経細胞の機能的成熟に重要であるかどうかを検証します。
さらに、③成熟期には、睡眠・覚醒・注意などに対応して、視覚野のアストロサイトと神経細胞の相互作用がどのように変化するかを解明し、アストロサイトの高次機能を含む多様な脳活動における機能を追求します。
小泉 修一(山梨大学・大学院医学工学総合研究部・医学学域・薬理学講座・教授)

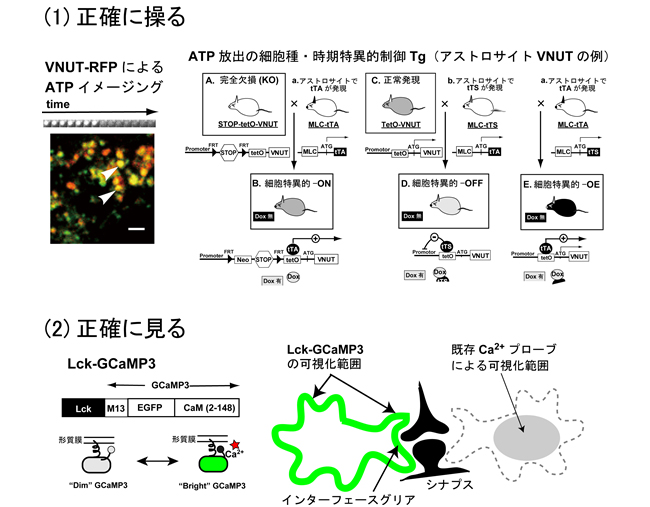
我々はこれまでに、グリア細胞の有する情報受容、発信、統合能力に注目し、特にグリア伝達の視点から、グリア細胞の機能及びグリア-神経細胞コミュニケーションの動作原理の解明を行ってきました。本研究では、新しく開発した(1)グリア伝達時空間制御動物、(2)新規膜移行型Ca2+プローブを用い、グリア伝達を正確に「操る」「見る」ことにより、グリア伝達の視点から巨大機能単位「グリアアセンブリ」動作原理の全容解明に望みます。
(1)グリア伝達を操る
グリア伝達では、細胞外ATPは中心的な役割を果たします。各種化学伝達物質が未発達な幼弱脳や、グリア機能が激変する病態時脳では、ATP及び関連ヌクレオチドによるグリア伝達の役割が、特に重要になることが示唆されています (Nature 2007; J Neurosci 2012)。KENGE-tetシステムによりATPグリア伝達(放出(VNUT)及び受容体(P2Y1R))を時期及び細胞種特異的にON/OFF/OE(過剰)に正確に制御します。これらグリア伝達制御技術により、グリア伝達がグリアアセンブリの作動様式に与える影響を解析します。
(2)グリア機能を見る
新規膜移行型カルシウムプローブLck-GCaMP3(Shigetomi et al, Nat Neurosci 2010; 2011)を用いたグリア-神経細胞インターフェースのイメージングから、本動作原理の解明を行います。グリア細胞間コミュニケーションとシナプスリモデリングに関してはA02岡部班と、霊長類への外挿に関してはA02高坂班と、また、ミクログリアとの相互作用に関してはA03井上班と連携します。新規グリアアセンブリ制御物質の探索に関しては、A01伊藤班と連携します。
伊藤 啓(東京大学・分子細胞生物学研究所・脳神経回路研究分野・准教授)

高度な分子遺伝学的手法が駆使でき、医学研究のモデル系としても欧米を中心に幅広く利用されているキイロショウジョウバエでは、哺乳類脳の血液脳関門、アストロサイト、オリゴデンドロサイトに機能の点でも形態の点でも対応するさまざまなグリア細胞が同定されています。
研究分担者の伊藤と粟崎健(杏林大学・医学部・生物学教室)は、ショウジョウバエの幼虫・成虫神経系に存在する全グリア細胞種を同定して分類体系を作り上げ(Roux Archive 1995, J Neurosci 2008)、神経回路網の再編成における軸索の貪食除去や回路形成制御にグリアが中心的に関わっていることを始めて発見するなど(Curr Biol 2004, Neuron 2006, Nat Neurosci 2011a, 2011b)、この分野で世界をリードしてきました。
本計画研究では最先端の遺伝子発現誘導技術とイメージング技術を駆使して、グリアアセンブリの制御を担う分子機構の解明をめざします。
(1)神経の機能操作で誘起されるグリアアセンブリ応答の解析
加齢や薬理学的手法による個体レベルの機能操作や、遺伝子発現誘導による特定のニューロンの活動亢進や変性に対し、グリアアセンブリがどのように応答するかを、グリア細胞種特異的な蛍光タンパク発現による形態的解析と、カルシウム濃度依存的蛍光タンパク発現ライブイメージングによる生理学的解析で明らかにします。
(2)グリアアセンブリの機能操作で誘起される神経回路の形態・機能異常の解析
外科的・薬理学的手法およびグリア細胞種特異的な発現誘導によってグリアアセンブリの機能を操作し、その結果起こる神経回路の形態的・生理学的異常を解析します。
(3)グリアアセンブリ制御分子の探索
グリア細胞種特異的mRNAseqによるトランスクリプトーム解析を行い、グリアの応答に連動して発現が変動する遺伝子を探索します。さらに、得られた候補遺伝子に対するRNAi誘導遺伝子の細胞特異的発現によって遺伝子機能をノックダウンし、神経や他のグリア細胞種におこる形態的生理学的機能への影響を解析します。
グリアアセンブリの応答と神経機能制御に関してはA01大木、飯野、A02岡部、竹林班、制御分子の探索に関してはA01小泉、A02高坂班、A03尾崎班と連携します。





