B. これまでの成果と今後の展望
6.分子病態の解析に基づいた孤発性ALSの分子治療へ
(ア)上記のような分子メカニズムが孤発性ALSに疾患特異的におこっており、それが運動ニューロン死の直接原因であること、を強く示す知見が蓄積してきている。
(イ)以上の結果から、分子治療標的として考えられるものは、
- ① ADAR2 活性の賦活
- 1. 期待される効果は、未編集型GluA2の発現抑制、AMPA受容体のCa2+透過性の正常化、それによる運動ニューロン死の阻止
- a) 薬剤によるADAR2活性上昇28
- b) 遺伝子導入によるADAR2発現上昇
- ② 未編集型GluA2を含むAMPA受容体の特異的阻害
- 1. 期待される効果は、AMPA受容体からのCa2+流入阻害により細胞内Ca2+濃度上昇の抑制
- a) 薬剤
- b) 低分子化合物
(ウ)これまでに行った前臨床治療研究成果
- ① ADAR2 活性の賦活
- 1. 培養細胞を用いたADAR2 賦活活性薬剤のスクリーニング
- a)複数のADAR2 活性賦活物質が得られている
- b)問題点としては、in vivoでの効果が必ずしも得られない、効果が持続しない、など
- 2. 分子病態モデルマウスを用いたADAR2 遺伝子による遺伝子治療29
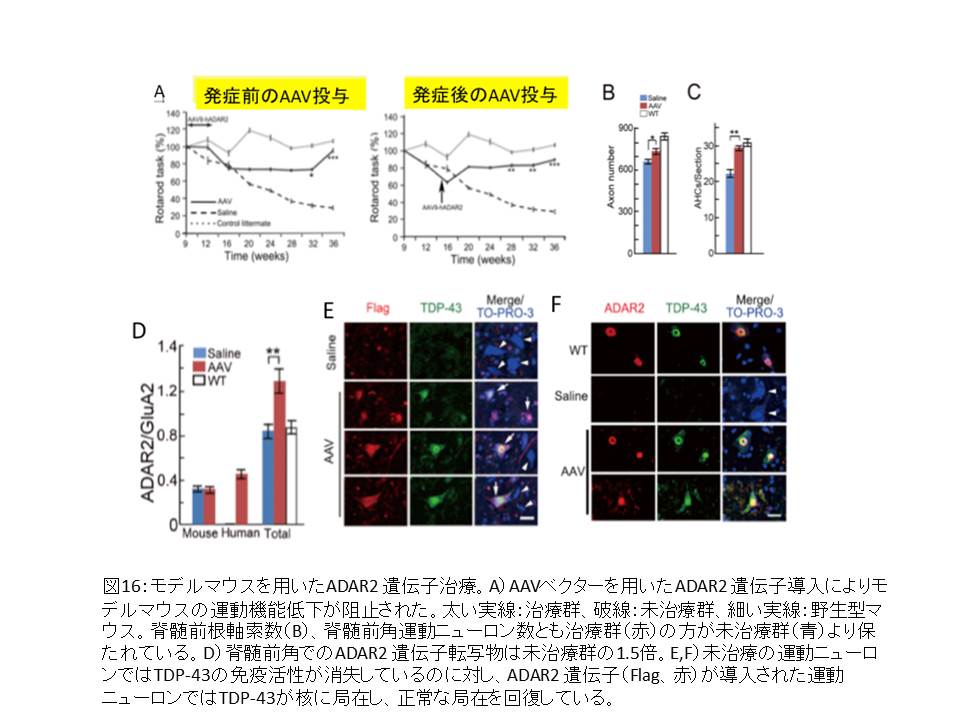 図16
図16
- a) ヒトADAR2 遺伝子(ADARB1)を搭載したAAV9ベクターを経静脈的ルートによりモデルマウスに投与
- b)モデルマウスに一回投与することにより、運動ニューロンでADAR2 の発現レベルを1.5倍に増加させた
- c)発症後投与でも、運動機能障害、運動ニューロン死を阻止し、TDP-43の局在異常を正常化した(図16)
- d)ニューロン特異的プロモーターを用いることにより、末梢臓器での発現は見られず、中枢神経においても、ADAR2 遺伝子発現によるグリア細胞の増勢などの副作用は全く見られなかったことから、重篤な副作用は生じないと考えられる
- ② 未編集型GluA2を含むAMPA受容体の特異的阻害
- 1. 分子病態モデルマウスを用いたAMPA受容体阻害剤ペランパネルによる治療30
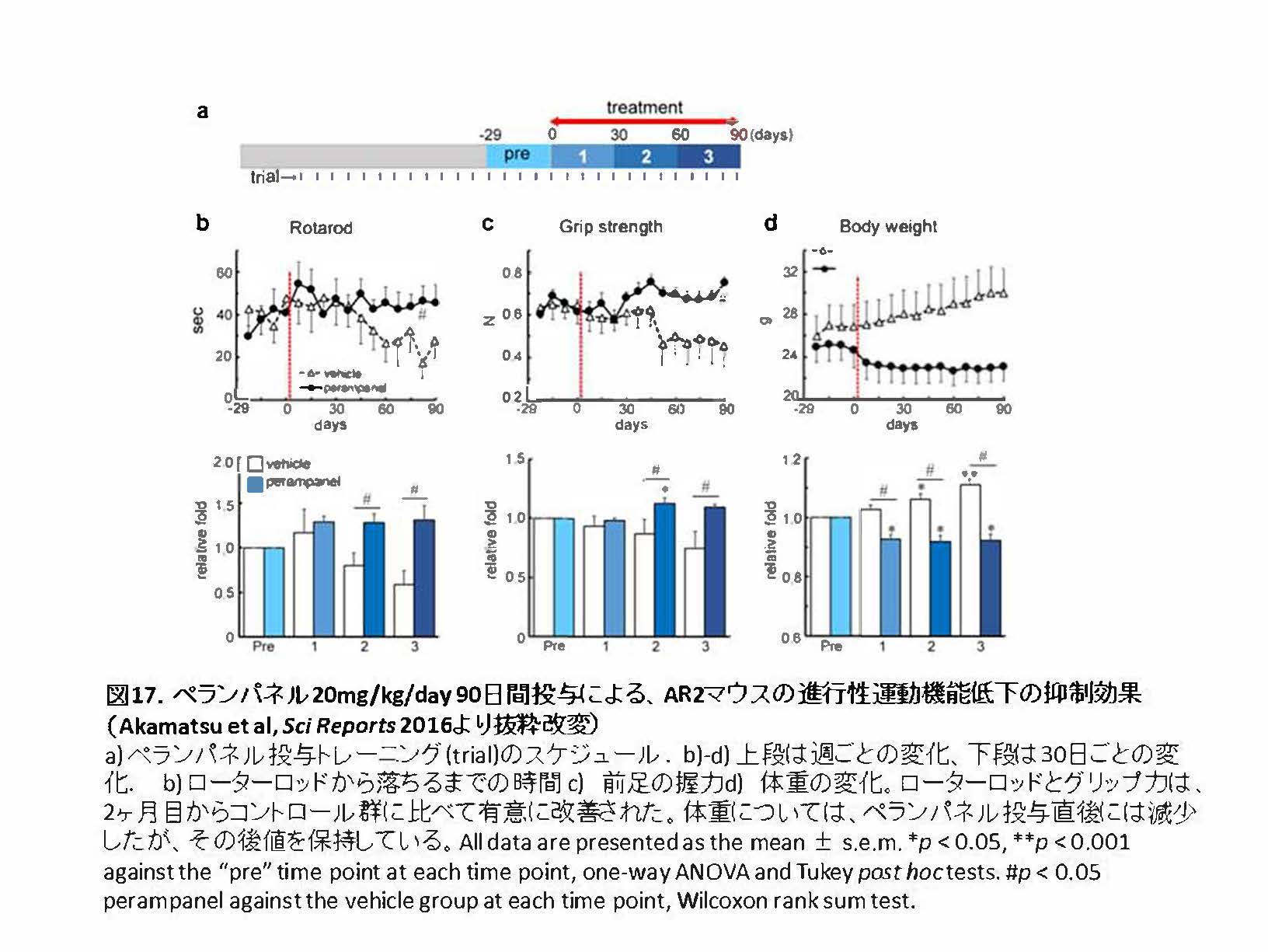 図17
図17
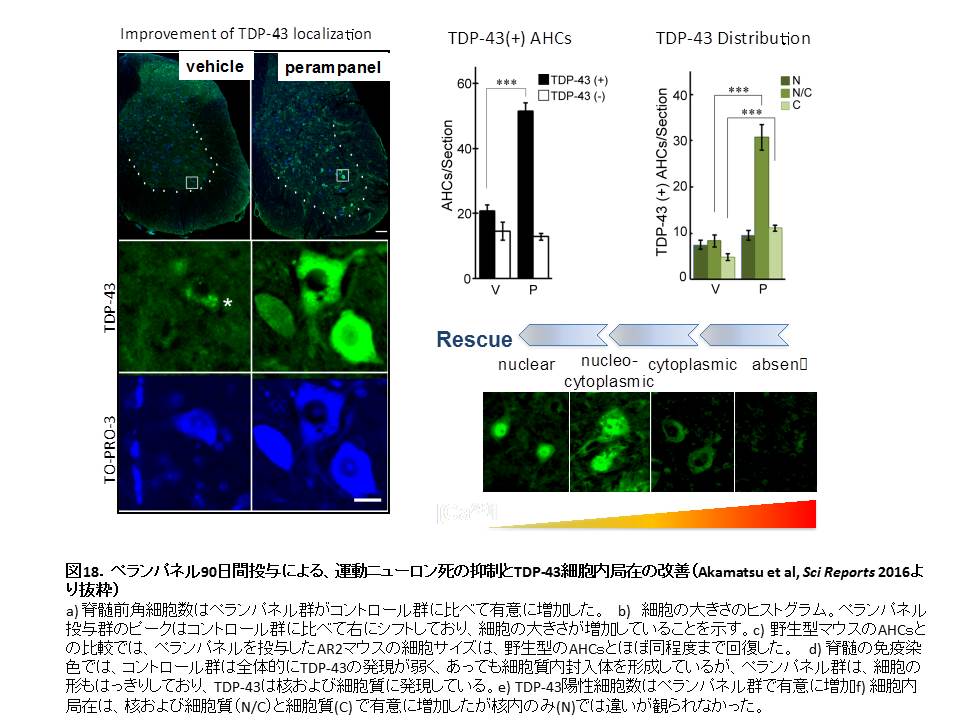 図18
図18
- a) ペランパネルを90日間連日経口投与
- b)顕著な治療効果が得られた:ALS症状の進行阻止、運動ニューロン死の阻止、運動ニューロンのサイズの回復、TDP-43病理の正常化(図17)(図18)
- c)抗てんかん薬として承認された維持用量(8-12mg)より少量での効果が得られ、マウスには投与後一過性の鎮静作用がみられたが、全例が20mg/kg/dayで投与可能であった
- 2. 分子病態がおなじなので、孤発性ALSの患者さんの治療に適用できる可能性が高い。
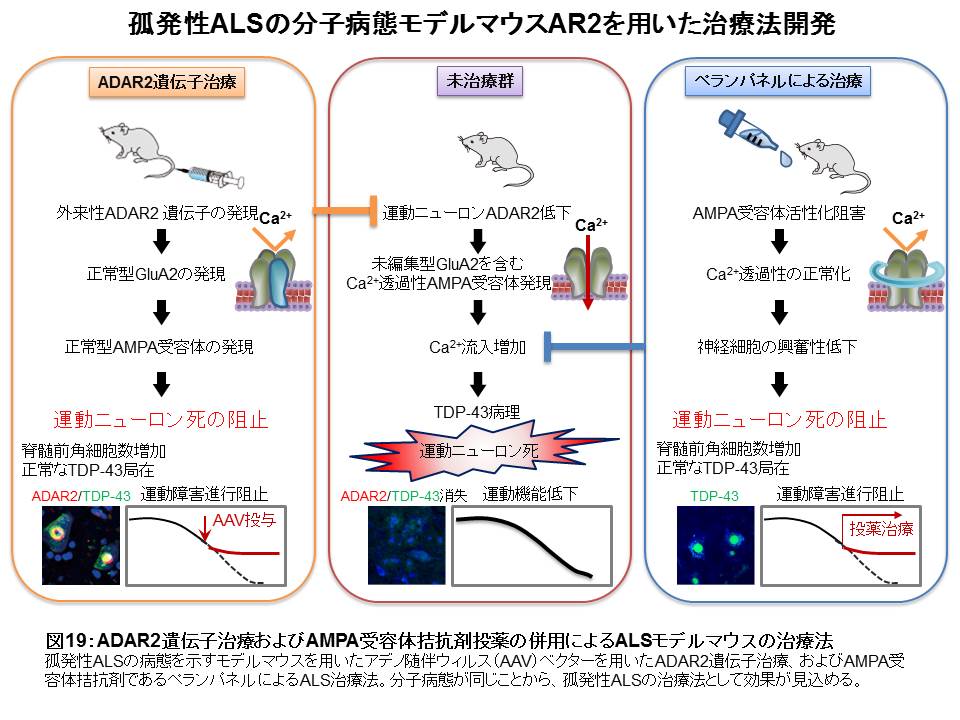 図19
図19
- 3. 問題点としては、AMPA受容体を抑えるのでグルタミンシステム阻害によるふらつき、眠気などの中枢神経活動抑制作用のため用量が限定される。
(エ) 今後の展望:ALSの遺伝子治療法としての開発のため以下の臨床試験を計画している
- ① ADAR2 遺伝子治療について
- 1. 臨床試験を行うための準備を行っている(遺伝子治療研究所)
- a)大型動物による至適投与ルート、至適投与量の検討
- b)GMPグレードのAAV-ADAR2ベクターの製造
- c)動物を用いた安全性/有効性の確認
- d)ヒトにおける臨床試験(安全性試験、治療効果評価)
- ② ペランパネル治療について
- 1. 臨床試験を行うための準備を行っている(責任研究者 東京医科大学神経内科相澤仁志教授)
- a)2017年2月:UMIN、日本医師会、ClinicalTrial Govへ治験登録済み。二重盲検平行群間比較ランダム化試験
- b)2017年4月に臨床試験を開始する予定
(オ) 治験以外、ALSの診療・研究全般に必要なことを含めた展望
- ① より選択性の高いAMPA受容体拮抗薬の開発
- 1. 上記の臨床試験で有効性が確認された場合には治療標的が絞られることになる
- ② バイオマーカーの開発(診断・病勢評価)
- ③ ADAR2 発現低下の分子メカニズムの解明
 図16
図16 図17
図17 図18
図18 図19
図19