
研究内容・業績
Research / 主な研究内容
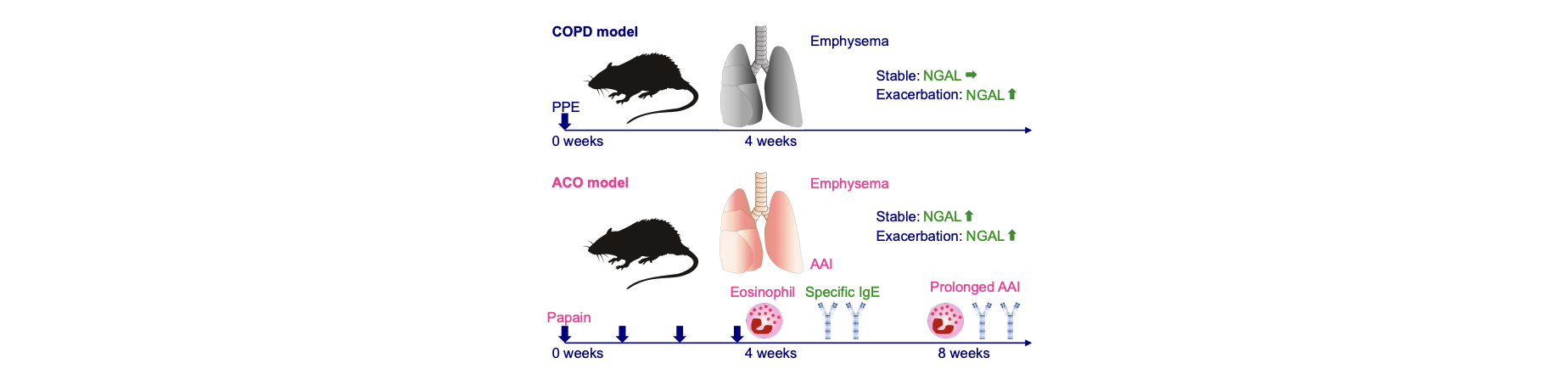
Asthma-COPD Overlap (ACO)マウスモデルの開発
気管支喘息と慢性閉塞性肺疾患(COPD)の特徴を併せもつACOは、気管支喘息やCOPD単独と比較して増悪しやすく、気管支喘息・COPD・ACO の病態の類似性や相違点を理解することは重要である。我々は条件検討を重ね、ACOに特徴的な病態を再現するマウスモデルを作出した。パパイン(システインプロテアーゼ)の経気道的な反復投与により、肺胞構造の傷害および特異的IgE産生を伴う好酸球性気道炎症が形成され、フレキシベントによる呼吸生理学検査では気道過敏性亢進と肺コンプライアンス上昇が生じることを確認した(Fukuda et al. Allergy. 2021)。さらにTLR3アゴニストであるpoly(I:C)投与によるウイルス感染を模倣した急性増悪モデル、ダニ抗原誘発性の気管支喘息モデル、エラスターゼの経気道投与によるCOPDモデルにおける分子病態との比較解析により、好中球ゼラチナーゼ結合性リポカリン(NGAL)がACOのバイオマーカーとなる可能性を示した。
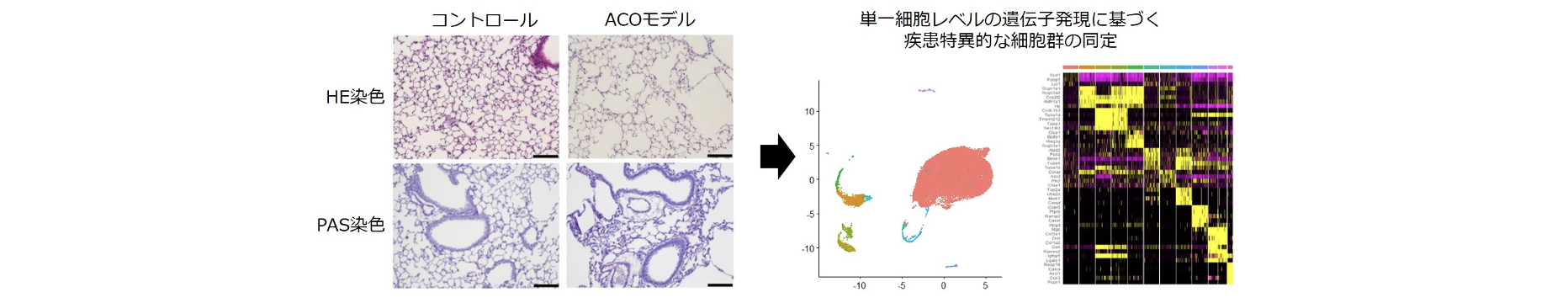
シングルセル解析によるII型肺胞上皮細胞(AT2細胞)の多様性の解明
金沢大学との共同研究では、シングルセル解析技術を応用し、気管支喘息・COPD・ACOの分子病態の詳細な解明を目指している。アラーミン分子を産生することで炎症応答の起点となるAT2細胞に着目し、疾患モデルマウスからMACS(Magnetic Cell Sorting)により高純度のAT2細胞を分取した。これにシングルセルRNA-seq解析を行い、気管支喘息やCOPDのマウスモデルでは認められない、ACOに特徴的なAT2細胞サブグループを同定した。さらにシングルセルATAC-seqなどのエピゲノム解析を組み合わせた多面的アプローチにより気管支喘息・COPD・ACOのバイオマーカーや治療標的分子を探索している。
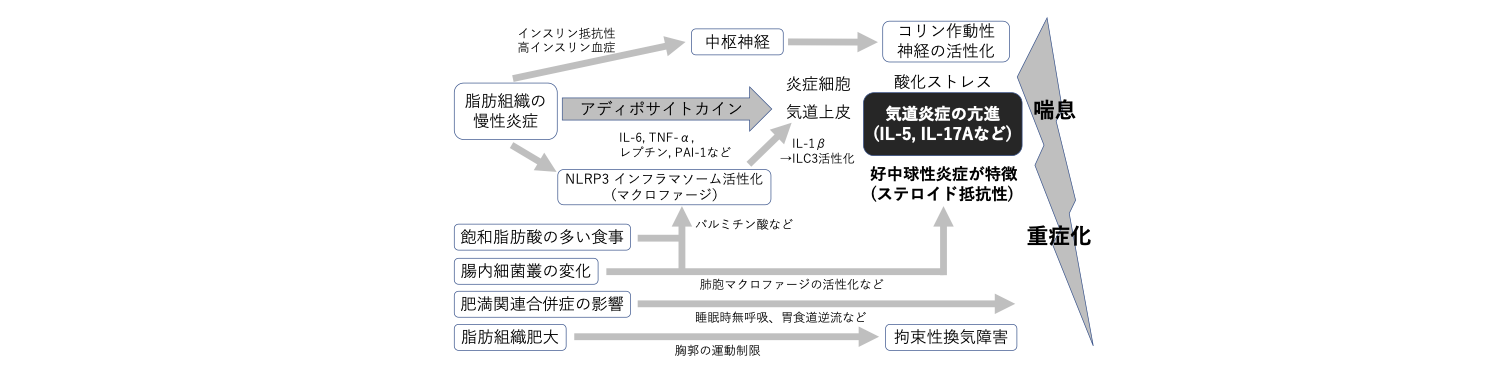
肥満関連喘息マウスモデルの病態解析
肥満は気管支喘息の難治化や増悪リスクと関連しており、肥満関連喘息では好中球性気道炎症の関与が指摘されている。我々は高脂肪餌を与えて著明な体重増加をきたした肥満マウスでは気道過敏性が亢進すること、さらに肥満マウスの脂肪組織や肺組織において、S100A8の発現が亢進していることを見出した。S100A8は好中球の細胞質に豊富に存在し、受容体となるTLR4やRAGEに結合して炎症応答を惹起する作用があるが、気管支喘息における病的意義は不明な点が多い。肥満マウスにおいてS100A8のデコイ受容体である可溶性RAGEの血中濃度が低下していることも我々は見出している。肥満関連喘息におけるS100A8-RAGEシグナルの関与を解明するため、RAGE(Ager)欠損マウスやTLR4欠損マウスを導入して解析を進めている。
呼吸器疾患の病態形成における自然免疫の関与
武蔵野大学との共同研究では、遺伝子改変マウスを用いた疾患モデルの作成やFACS(Fluorescence Activated Cell Sorting)を駆使した細胞レベルでの解析を通じ、自然免疫や獲得免疫が呼吸器疾患の病態形成に与える影響を検討している。TLR4シグナルの下流分子IRF3の欠損マウスにおいて、エラスターゼおよびLPS投与によるCOPD急性増悪モデルを作成すると、気腫形成が抑制される一方で好中球浸潤は亢進し、さらに好中球のアポトーシスやオートファジーの抑制が生じることを明らかにした(Ishii et al. J Immunol. 2017)。TLR4欠損マウスにおけるダニ抗原誘発性の気管支喘息モデルでは、好酸球や好中球浸潤を伴う気道炎症の経時的変化の様相が野生型マウスとは異なっており、この違いには骨髄由来抑制細胞(MDSC)におけるIL-10の産生低下が関わっている可能性が考えられた(Ishii et al. Scand J Immunol. 2018)。さらにTLR2欠損あるいはTLR4欠損マウスでIL-33点鼻投与による気管支喘息モデルを作成し、2型自然リンパ球(ILC2)を回収して細胞応答性を解析することで、ILC2からの2型サイトカイン(IL-5・IL-13)の産生調節において、TLR2を介したシグナルが関わっていることを明らかにした(Ishii et al. Clin Exp Allergy. 2019)。またTLR4欠損あるいはMD-2欠損マウスでダニ抗原誘発性の気管支喘息モデルを作成することで、MD-2が気道上皮細胞からの炎症メディエーター産生を低下させ、さらに樹状細胞の活性化や気管支喘息の病態形成を抑制する効果があることを明らかにした(Ishii al. Clin Exp Allergy. 2022)。IL-33などのアラーミン分子の肺上皮細胞からの産生過程における、RIPK3の機能やネクロトーシスの役割についても解析を進めている。
ヒト気道上皮細胞の機能解析
気道上皮は多彩な液性因子の産生を介して気道局所での炎症応答を調節している。気道上皮細胞株を用いた検討で、TNFスーパーファミリー分子であるLIGHT(TNFSF14)によってサイトカイン・ケモカインの産生が亢進することや、IL-8の発現制御においてMAPKやNF-κBシグナルが関与していることを示した(Mikami et al. PLoS One. 2014)。さらにIL-17Aとpoly(I:C)が協調的に作用し、気道上皮細胞における好中球遊走因子(IL-8・CXCL1)の発現を誘導することを見出した(Matsuzaki et al. PLoS One. 2015)。North Carolina大学Boucher研究室の協力を得て、呼吸器疾患患者由来の肺組織から初代培養気道上皮細胞を樹立する実験系も導入しており、基底細胞から線毛上皮細胞を分化誘導させる培養法や、CRISPR/Cas9による遺伝子ノックアウト法を組み合わせた機能解析を進めている。
気道リモデリングにおけるIL-13の関与
気管支喘息や肺線維症における気道リモデリングの病態においてIL-13は重要な役割を担っており、IL-13シグナルを標的とした治療薬も開発されている。気道平滑筋細胞をIL-13で刺激すると、様々な細胞内シグナル経路が活性化され、気管支喘息や肺線維症のバイオマーカーとして注目されているペリオスチンの産生が亢進することを見出した(Makita et al. Int Arch Allergy Immunol. 2018)。さらに肺線維芽細胞をIL-13で刺激し、網羅的かつ経時的な遺伝子発現解析を行ったところ、好酸球遊走因子(CCL11・CCL26)をふくむケモカインシグナルが増強する一方で、インターフェロン-α/βシグナルが抑制されることを見出した。さらにSOCSファミリーであるCISH分子がIL-13により強く発現誘導された。CISHはCCL26の産生を抑制することも明らかにし、IL-13によって惹起される好酸球性炎症の病態において、CISHはネガティブフィードバック制御に関わっている可能性を示した(Takeshima et al. Allergol Int. 2019)。
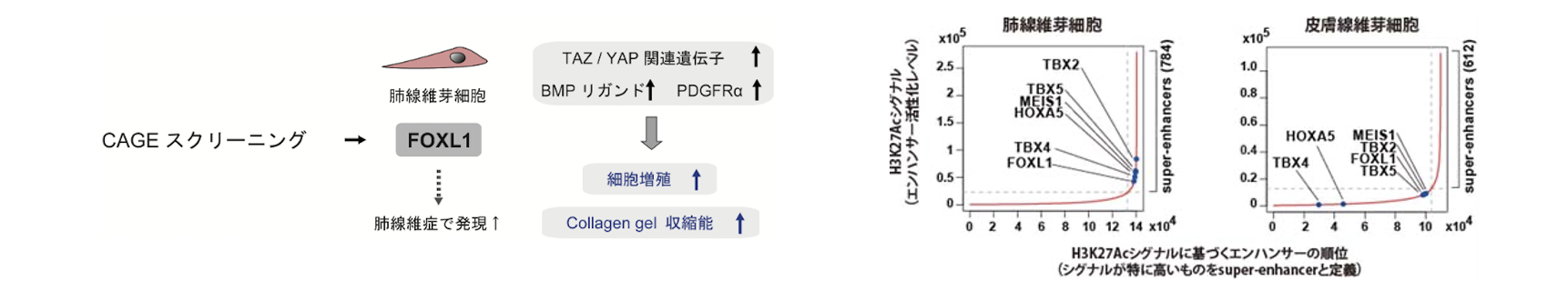
肺線維芽細胞の臓器特異性
線維芽細胞は細胞外基質の産生・分解を介して組織構造の維持を担っている。我々は理化学研究所FANTOM5データベースを活用し、線維芽細胞の遺伝子発現プロファイルを臓器横断的に比較することで(Horie et al. Sci Rep. 2016)、肺線維芽細胞において特徴的な遺伝子を同定し、このうち一部の転写因子(TBX2・TBX4・TBX5・FOXL1・FOXP1・MEIS1・TGIF1・HOXA5)がスーパーエンハンサーと関連することを見出した。さらにTBX4を発現抑制した肺線維芽細胞でRNA-seq解析を行い、TBX4がスーパーエンハンサー関連遺伝子を広汎に制御することを明らかにした。肺線維芽細胞をTGF-βで刺激すると、TBX2・TBX4・TBX5の発現が抑制されることから、TGF-βシグナルが活性化している肺線維症などの疾患病態において、T-boxファミリー転写因子の発現低下が、肺線維芽細胞の活性化と関連していると考えられた(Horie et al. Am J Physiol Lung Cell Mol Physiol. 2017)。肺線維芽細胞ではFOX遺伝子クラスター(FOXF1/FENDRR・FOXC2・FOXL1)の活性化も特徴的であり、さらにFOXL1は特発性肺線維症の肺線維芽細胞において発現が高く、BMPリガンド・アンタゴニストなどの発現制御を通じて細胞機能を調節していることを明らかにした(Miyashita et al. Am J Respir Cell Mol Biol. 2020)。
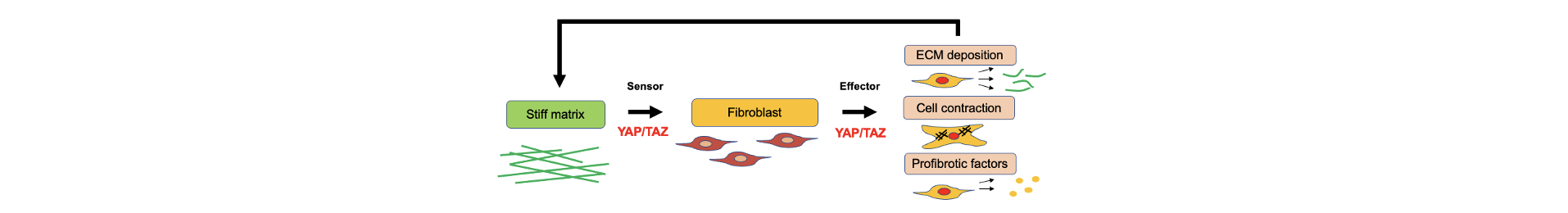
肺線維芽細胞における転写共役因子TAZの機能
Hippoシグナルの下流で機能する転写共役因子TAZ(WWTR1)は、TEADなどの転写因子と結合し、CTGFなどの遺伝子発現制御に関与している(Saito et al. Am J Physiol Lung Cell Mol Physiol. 2015)。 特発性肺線維症の肺組織における線維芽細胞巣ではTAZの発現が高く、肺線維芽細胞を用いた機能解析により、TAZが筋線維芽細胞への分化・細胞増殖・遊走・マトリックス収縮を促進し、線維化の病態に寄与することを見出した(Noguchi et al. Sci Rep. 2017, Noguchi et al. Int J Mol Sci. 2018)。さらにTAZおよびTGF-βシグナルによって発現誘導されるGremlin-1に着目し、特発性肺線維症の肺組織におけるRNAscope(RNA in situ hybridization)やシングルセルRNA-seq解析、初代培養肺線維芽細胞における機能解析など、Gremlin-1の病的意義について多面的な検討を行っている。
肺線維症の新規治療法の探索
肺線維症に対して他疾患に対する既存薬を活用する、いわゆるドラックリポジショニングの可能性を探索している。前立腺肥大症治療薬であるα1遮断薬Naftopidilは、肺線維芽細胞の増殖やコラーゲン産生を抑制し、ブレオマイシン誘導性の肺線維症マウスモデルにおいて線維化を抑制することを明らかにした(Urushiyama et al. J Cell Mol Med. 2019)。東京理科大学および日本医科大学との共同研究では、ケモカイン受容体CCR2の会合分子FROUNTの阻害作用を示す、アルコール依存症治療薬Disulfiramの効果を検証している。ブレオマイシン誘導性の肺線維症マウスモデルでは、Disulfiram投与によって肺組織へのマクロファージの浸潤や線維化が抑制されることを見出した。この知見に基づき、肺線維症患者に対するDisulfiramの治療効果を検証する臨床試験を計画・準備している。さらに呼吸器外科との共同研究では、肺移植を受けた患者の切除肺組織から複数のサンプルを採取してRNA-seq解析を行い、病理学的所見との対比させることで、線維化病変と関連するバイオマーカーを探索している。また肺線維症の肺組織からの初代培養肺線維芽細胞を樹立するバイオバンキングも進めており、細胞機能解析に活用している。
非小細胞肺癌におけるマルチオミクス解析
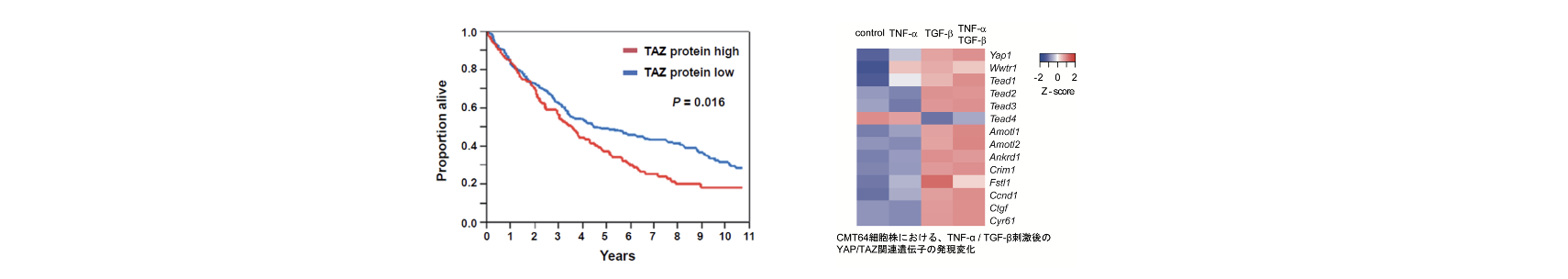
FANTOM5やTCGA(The Cancer Genome Atlas)などのデータベースの統合解析により、DNA低メチル化と関連して非小細胞肺癌において特異的な発現上昇を示す遺伝子群を同定した(cancer testis antigenやnon-coding RNAをふくむ)。このうちMYEOV分子が肺癌細胞の増殖・生存・浸潤を促進させること、非小細胞肺癌患者の予後不良と関連することを明らかにした(Horie M et al. Mol Cancer Res. 2017)。Uppsala大学Micke研究室との共同研究では、SNPアレイ・マイクロアレイ・RNA-seq・組織アレイの免疫組織染色の統合解析を進めている。TAZの高発現は非小細胞肺癌における予後不良因子であることを示し、さらに培養細胞やマウスモデルを用いた機能解析により、TAZが非小細胞肺癌の腫瘍形成を促進させることを見出した(Noguchi et al. Clin Cancer Res. 2014)。肺腺癌細胞におけるTGF-β誘導性の上皮間葉転換における選択的スプライシングやTAZ/YAPシグナルとのクロストーク、臨床的関連性についても明らかにした(Miyashita et al. Sci Rep. 2021)。
ASCL1陽性の肺腺癌サブタイプ
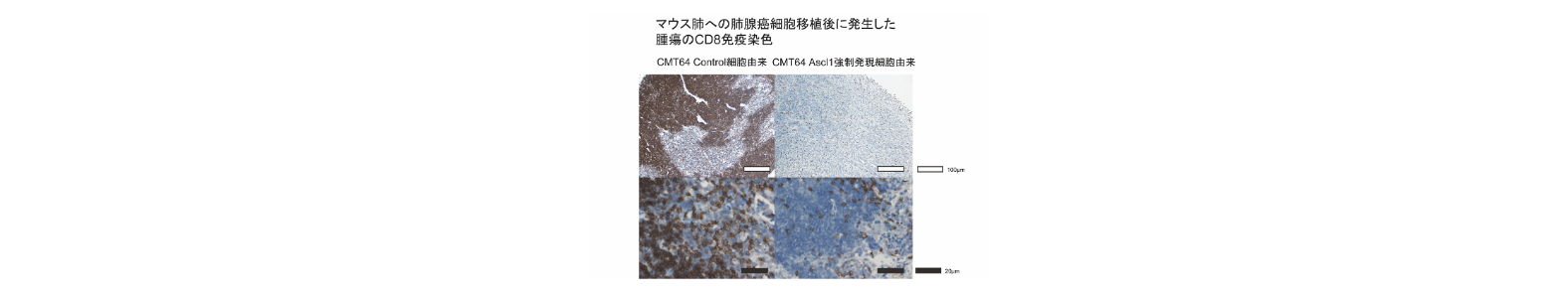
肺腺癌は分子生物学的に不均一であり複数のサブタイプが存在する。ASCL1は神経内分泌分化を誘導する転写因子であり、肺腺癌の約10%でも発現している。ASCL1陽性の肺腺癌は喫煙歴と関連しており、全ゲノムレベルでDNA低メチル化状態にあり、免疫細胞浸潤や免疫応答に乏しい遺伝子発現パターンを呈していた。組織アレイにおける免疫組織染色では、ASCL1を発現する肺腺癌では免疫チェックポイント阻害剤の有効性予測の指標となるPD-L1蛋白の発現がみられなかった。さらにASCL1がスーパーエンハンサー関連遺伝子の発現を調節しており、細胞増殖・生存・細胞周期を制御することを明らかにした(Miyashita et al. J Thorac Oncol. 2018)。ASCL1陽性の肺腺癌では免疫細胞の腫瘍内浸潤が低下しており、リンパ球浸潤に関与するケモカイン(CXCL10・CCL20など)の産生が低下していた。さらに同系同所移植によるマウス肺癌モデルを確立し、ASCL1の腫瘍形成促進作用を明らかにした(Miyashita et al. Cancer Lett. 2020)。ASCL1陽性の肺腺癌における特徴的なmiRNAの発現パターンも同定しており、病態との関連について解析を進めている。
肺小細胞癌のサブタイプ
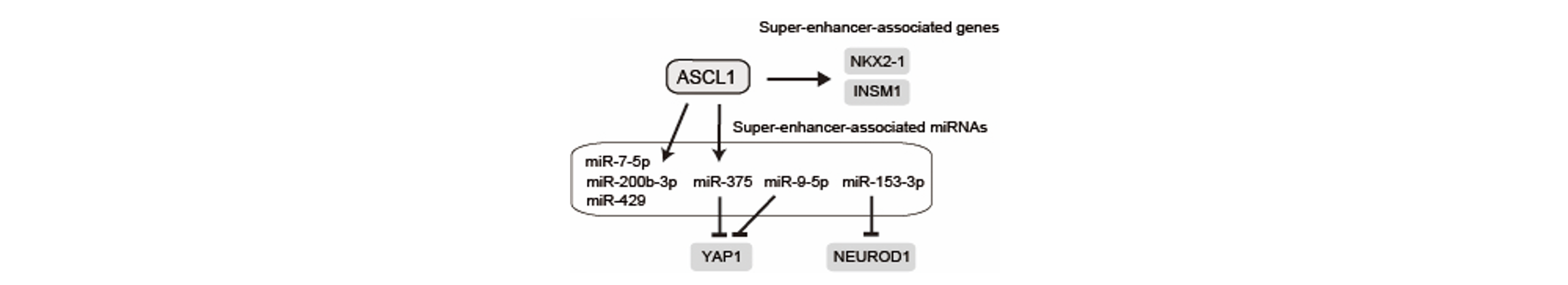
肺小細胞癌の細胞株や腫瘍組織における遺伝子発現パターンを解析し、ASCL1・NEUROD1・YAP/TAZの発現レベルに基づく分子サブタイプを世界に先駆けて同定し、YAP/TAZの発現が細胞接着性に関与していることや、分子サブタイプにおける薬剤感受性の違いを明らかにした(Horie et al. Cancer Sci. 2016)。TTF-1は肺の器官形成や肺胞上皮細胞分化を司るマスター転写因子である。肺小細胞癌ではTTF-1がASCL1によって誘導され、さらにTTF-1はmiRNAを介してNFIBなどの遺伝子発現制御に関わることや、アポトーシスを抑制する作用を有することを明らかにした(Horie et al. J Pathol. 2018)。ASCL1陽性の肺小細胞癌細胞株において、CUT&Tag法を活用して全ゲノムレベルでヒストン修飾を同定し、さらにRNA-seq・miRNAアレイによる発現解析を行うことで、ASCL1がスーパーエンハンサー関連miRNAの発現制御を通じて分子サブタイプを特徴づけていることも明らかにした(Miyakawa et al. Cancer Sci. 2022)。肺小細胞癌の一部ではASCL1とNEUROD1が共に陽性となる症例がみられており、ASCL1とNEUROD1によって制御される遺伝子・miRNAの共通点や相違点を検討し、さらにスーパーエンハンサーや分子サブタイプとの関連について解析を進めている。
入院包括医療費支払制度(DPC)データベースを用いた研究
臨床疫学・経済学分野との共同研究では、DPCデータベースを用いた解析により、様々な呼吸器疾患の疫学研究に取り組んでいる。罹患している呼吸器疾患、使用した薬剤、全身の合併症などを評価し、在院死亡率や治療効果に寄与する因子の検討を行っている。非小細胞肺癌(Urushiyama et al. Cancer Med. 2018)や肺小細胞癌(Urushiyama et al. BMC Cancer. 2017)の術後治療法の選択に関して、いわゆるリアルワールドデータに基づく臨床エビデンスを報告している。抗癌剤Irinotecan投与時において半夏瀉心湯の併用が効果的である可能性も示した(Urushiyama et al. J Clin Med. 2018)。気管支鏡検査に関しては、各医療機関における症例数(Hospital Volume)と死亡率の関連性について明らかにした(Hiraishi et al. Respiration. 2019)。さらに特発性肺線維症に対するPirfenidoneの術前投与により術後合併症のリスクが低減しうること(Urushiyama et al. Respirology. 2021)、間質性肺疾患の急性増悪に対してNintedanibが有効である可能性(Urushiyama et al. ERJ Open Res. 2022)、などを示す解析結果も報告している。
カルテ情報を用いた後ろ向き観察研究(多施設共同研究)
呼吸器内科の臨床現場における課題に取り組むため、診療記録の解析も行っている。閉塞性肺疾患の患者に対して術前に気管支拡張薬を使用する効果(Mikami et al. Clin Respir J. 2020)、造血器腫瘍の患者における気管支鏡検査の有用性(Makita et al. Clin Respir J. 2018)、間質性肺疾患の患者における術後の急性増悪のリスク因子(Hosoki et al. BMJ Open Respir Res. 2020)、などを明らかにしてきた。非小細胞肺癌の約60%にドライバー遺伝子変異を認め、それを標的とした分子標的治療薬は進行期で高い有効性を示す。そのような患者集団における無症候性脳転移には薬物療法を先行することが多いが、薬物療法のみで経過をみるべきか初期から放射線療法を併用すべきかについて、現時点で明確なエビデンスがないため、これを多施設共同で後ろ向きに検討している(※)。 ※対象者は脳転移を有する肺癌と診断されたドライバー遺伝子変異陽性患者のうち、2018年8月から2020年12月の間に本研究の協力施設でチロシンキナーゼ阻害薬(TKI)等の内服治療を受けられた方です。オプトアウトなど含めた研究説明文章は こちらに公開しています。研究説明文書
学会発表・講演実績
論文発表
海外書籍
PM2.5: Role of Oxidative Stress in Health Effects and Prevention Strategy
nova science publishers
Tadashi Kohyama: Effects of DEP Inhalation on Development of Infectious Diseases
Masafumi Horie: DNA Adduct Formation by Diesel Exhaust and its Relevance to Carcinogenesis
Yasuhiro Yamauchi: Effects of Diesel Exhaust Particles on the Cardiovascular System: Experimental and Clinical Findings
Satoshi Noguchi: Neurotoxicity of DEPs
Yu Mikami: Adverse Fetal Effects of Diesel Exhaust –Induced Oxidative Stress