進行中の主なプロジェクト
1)細胞性粘菌を用いた細胞分化/細胞運動のメカニズム解析
1−1)モデル生物「細胞性粘菌」とは?
1−2)粘菌の柄細胞分化誘導因子DIFの研究
2)細胞性粘菌由来の低分子生物活性物質をリード化合物とした薬剤開発
2−1)抗がん剤の開発
2−2)肥満/糖尿病治療薬の開発
2−3)免疫制御剤の開発
2−4)抗トリパノソーマ剤の開発
2−5)抗菌薬の開発
2−6)細胞性粘菌由来の新規生物活性物質の研究
2−7)私たちの研究と健康科学/スポーツ科学との接点
3)重金属に関する生物学的研究
プロジェクトの概説
1)細胞性粘菌を用いた細胞分化と細胞運動のメカニズム解析
1−1)モデル生物「細胞性粘菌」とは?
細胞性粘菌類は、世界中の森の落ち葉の下などに生息する土壌微生物(真核生物)で、古くから発生生物学や細胞生物学の「モデル生物」として利用・研究されてきた。細胞性粘菌類は、発生過程の最終段階でカビによく似た形状の子実体を形成するが、分類学的にはカビ(真菌)類とは異なる「界」(「原生生物界」or「変形菌界」)に属するユニークな生物群である。
Dictyostelium discoideum(和名「キイロタマホコリカビ」)は、モデル生物としてもっともよく研究されている粘菌種で、その和名のごとく淡黄色の子実体を形成する(図1写真)。D. discoideum(以後、単に「粘菌」と呼ぶ)の生活環は、増殖期(単細胞期)と形態形成期(多細胞期)に大別される(図1)。
増殖期の粘菌アメーバ(単細胞、半数体)は、周囲のバクテリアを食べながら二分裂で増殖をする。飢餓状態になると、粘菌アメーバは集合して多細胞体を作り、最終的に胞子塊と柄から成る子実体を形成する。
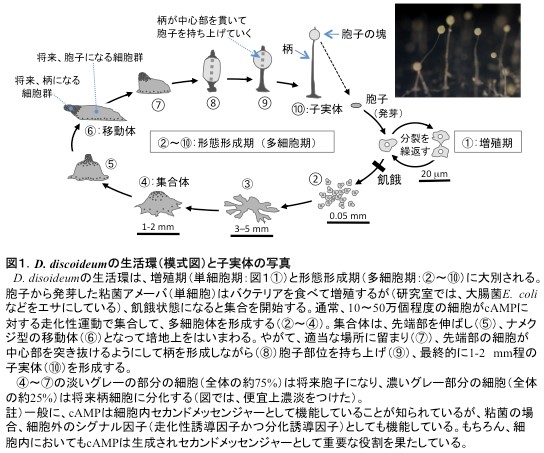
飢餓直後、ほぼ均質(未分化)であった細胞群が集合し、胞子と柄細胞に分化しながら子実体を完成するまでに要する時間は(温度や湿度などの条件にもよるが)、およそ24時間と短い。
このように、粘菌は、1)生活環が短く、分化系がシンプル、2)取り扱いや生育が簡単、かつ、3)半数体ゆえ遺伝子改変操作も容易なため、細胞分裂、細胞運動、細胞分化、形態形成などのメカニズム解析の優れたモデル生物として世界中で利用されている。
現在、我々の研究室では、この粘菌細胞を利用して、細胞分化と細胞運動のメカニズム解析を進めている。
1−2)粘菌の柄細胞分化誘導因子DIFの研究
1980年代後半、英国のKayの研究グループは、粘菌の柄細胞分化誘導因子differentiation-inducing factor-1,
-2, -3 (DIF-1, -2, -3)を単離、同定した(図2)[文献1,2]。
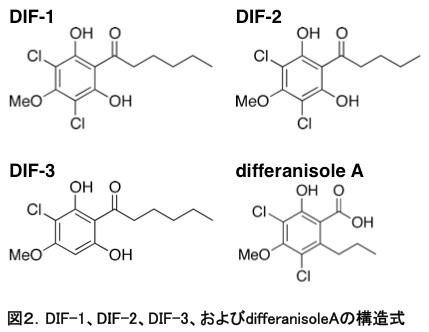
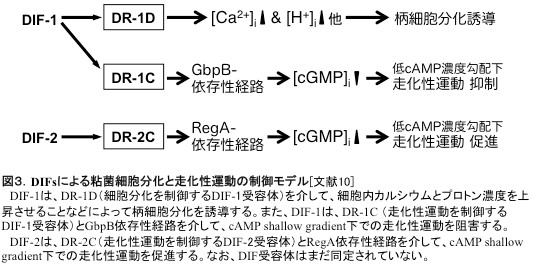
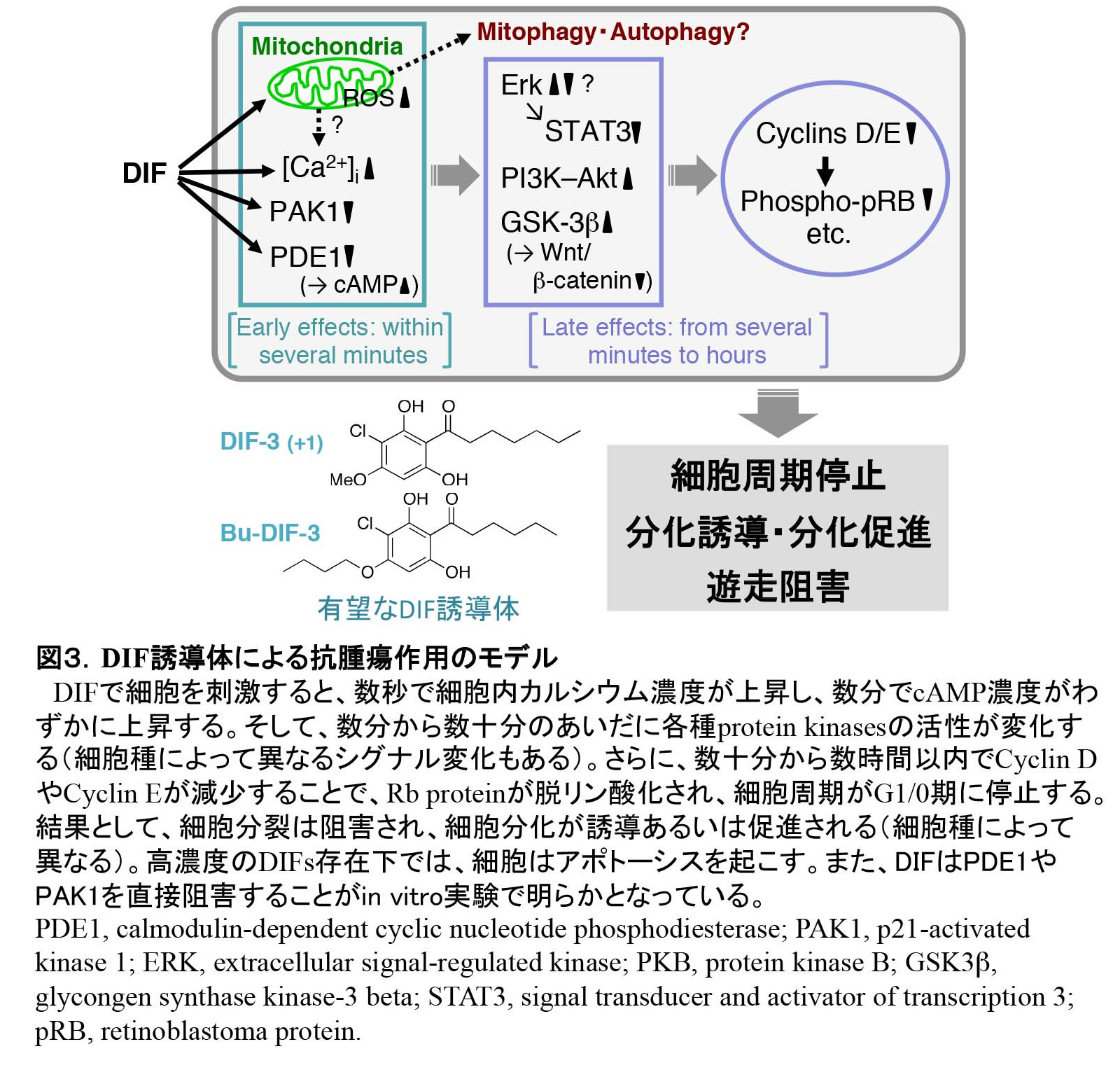
DIF-1, -2, -3は、塩素原子を含むアルキルフェノン(alkylphenone)で、柄細胞分化誘導活性はDIF-1がもっとも強く、nMオーダーで顕著な分化誘導作用を示す。DIF-1の作用機序の詳細は不明だが、DIF-1は(少なくとも一部)細胞内カルシウム濃度とプロトン濃度を上昇させることにより機能することが示唆されている(図3)[文献3]。なお、DIF-1の受容体は未だ同定されていない。ところで近年、粘菌の柄細胞分化はAutophagic cell death (ACD)のカテゴリーに入ることが示されており、DIF-1による柄細胞分化過程はACDの解析モデル系としても注目されている[文献4]。
一方、DIF-2はDIF-1の40%程度、DIF-3は4%程度の柄細胞分化誘導活性を有することが報告されている[文献5,6]。DIFs発見後しばらくして、DIF-3はDIF-1の分解産物であることが判明したが、DIF-2はDIF-1の分解産物でもなく、DIF-1生合成過程の中間体でもなかった[文献6,7]。そのため、DIF-2には分化誘導以外の何か別の機能(発生初期における機能)があるのではないかと推測されてきたが[文献8]、その正体は長いあいだ不明であった。
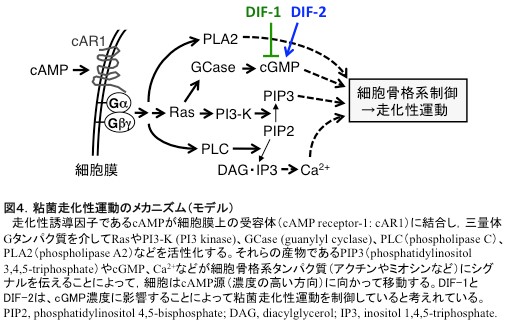
前項で概説したように、飢餓状態の粘菌細胞はcAMPに対する走化性運動(と細胞接着)によって集合し、多細胞体を形成する(前項図1②〜④)。この走化性運動のメカニズムは、およそ図4のように理解されている。
桑山(筑波大学)と久保原は、簡単なアッセイ系を利用して、粘菌走化性運動に対するDIF-1とDIF-2の効果を検討した。その結果、低濃度のcAMPに対する走化性運動をDIF-1が抑制し、逆にDIF-2が促進することを発見した。つまり、DIF-1とDIF-2は分化誘導因子であると同時に、走化性運動の正・負の制御因子(modulators)であることが明らかとなった(図3,4)[文献9−12]。
現在、我々の研究室では、粘菌細胞におけるDIFsの作用機序の解析を進めている。
[この項目の参考文献]
1. Morris, H.R. et al. Nature 328, 811-814. (1987).
2. Morris, H.R. et al. Biochem. J. 249, 903-906. (1988).
3. Kubohara, Y. & Okamoto, K. FASEB J. 8, 869-874. (1994).
4. Calvo-Garrido, J. et al. Autophagy 6, 1-16. (2010).
5. Masento, M.S. et al. Biochem. J. 256, 23-28. (1988).
6. Kay, R.R. et al. Development 107, 81-90. (1989).
7. Kay, R.R. et al. Semin. Cell Dev. Biol. 10, 577-585. (1999).
8. Wurster, B. & Kay, R.R. Dev. Biol. 140, 189-195. (1990).
9. Kuwayama, H. & Kubohara, Y. PLoS ONE 4, e6658. (2009).
10. 久保原禅、桑山秀一. 生化学 82, 1132-1137. (2011).
11. Kuwayama et al. Cell Struct. Func. 36, 21-26. (2011).
12. Kuwayama, H. & Kubohara, Y. FEBS Lett. 590, 760-768. (2016).
2)細胞性粘菌由来の低分子生物活性物質をリード化合物とした薬剤開発
細胞性粘菌類と同じ真核土壌微生物である真菌類は、抗生物質を含む多くの生物活性物質を産生しており、創薬資源として人類に多大な貢献をしてきた。しかしながら、未だ治療法が確立されていない(治療薬がない)感染症や難病は少なからず存在するうえ、既存薬に対する耐性菌の出現や副作用の問題もあり、新規薬剤開発・創薬に対する社会的ニーズは大きい。
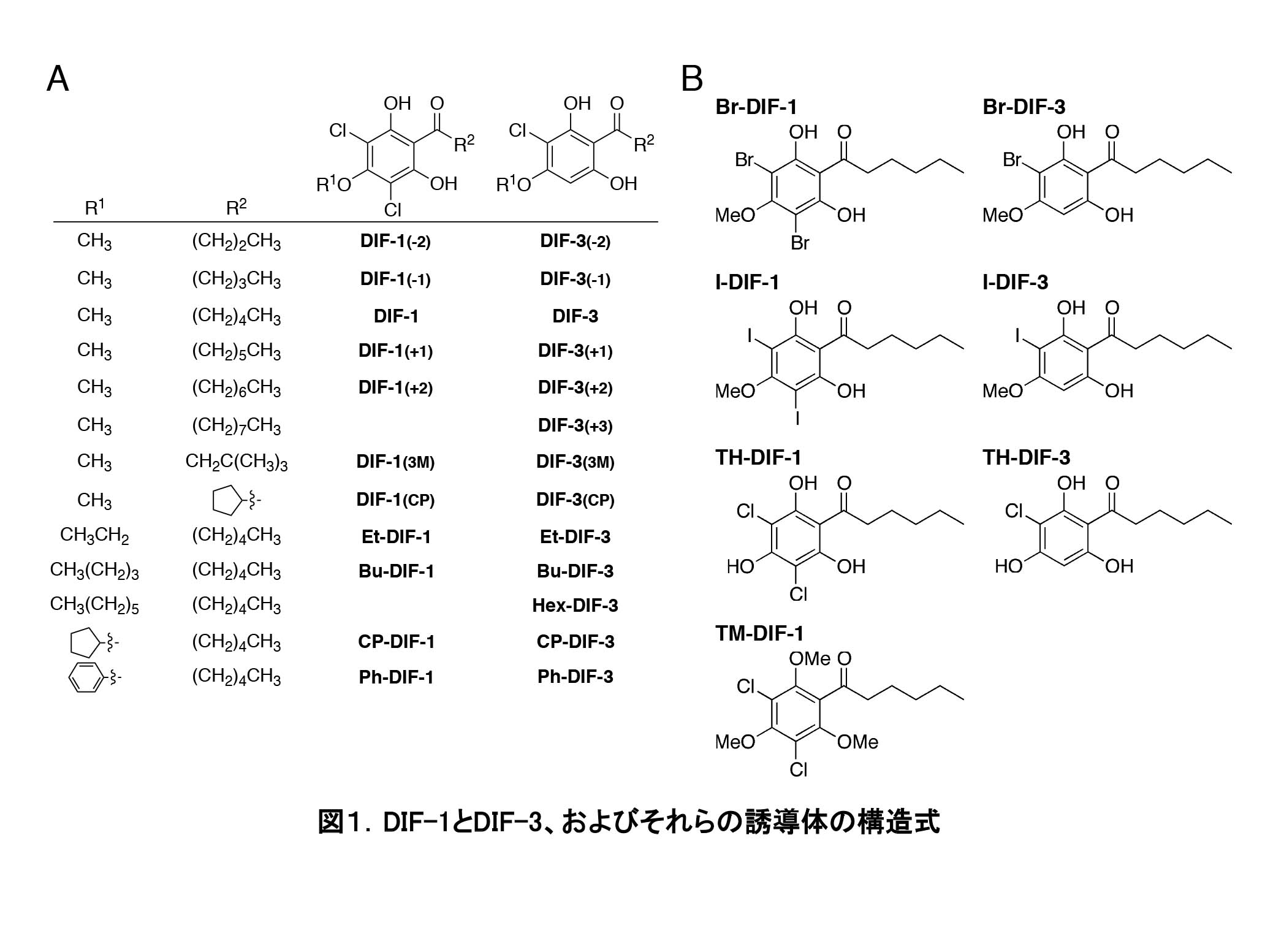
実は近年、細胞性粘菌類は「未開拓(未利用)創薬資源」としても注目されつつある。我々の研究室と東北大学薬学研究科天然物化学教室の研究グループは、細胞性粘菌由来の生物活性物質をリード化合物とした新規薬剤開発を進めている[文献1]。中でも、DIFsとそれらの誘導体(図1)に関する研究を精力的に展開している。
[参考文献]
1. Kubohara, K. & Kikuchi, H.Cells8, 6.(2019).
2-1)抗がん剤の開発
粘菌の柄細胞分化誘導因子DIF-1発見の2年程前、理化学研究所のAsahiらは、マウス赤芽球性白血病細胞に対する増殖抑制と分化誘導活性(ヘモグロビン産生誘導能)を指標とした「抗腫瘍因子」のスクリーニングを行い、真菌の一種Chaetomium(和名なし)の培養上清よりdifferanisole A (DA: 前項図2)を単離、同定していた[文献1]。
Asahiと久保原らのグループは、DIF-1とDAの類似性に着目し、DIF-1(数 µM−20 µM程度)もDAと同様の抗腫瘍活性を有することを見出した(しかも、DIF-1はDAよりも強い活性を有していた)[文献2]。
DIFsの抗腫瘍活性を比較検討した結果、興味深いことに「DIF-3 > DIF-1 > DIF-2」の順に活性が高いことが明らかとなった(図1)[文献3]。その後、久保原と東北大学薬学研究科の研究グループは、およそ30種類のDIF誘導体を用いた「化学構造-活性相関」解析を進め、より強力な活性を有するDIF-3誘導体を見出している[文献4]。
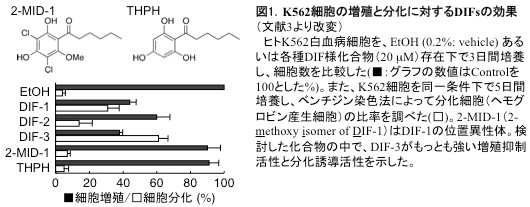
DIFsの作用機序については、1)DIFsが細胞内カルシウム濃度を上昇させること[文献3,5]、2)カルモジュリン依存性cAMP/cGMP分解酵素(PDE1)を阻害すること[文献6]、3)ERKやGSK3βなど各種キナーゼ活性に影響すること[文献7,8]、4)Cyclin DやCyclin Eの遺伝子発現とタンパク質レベルを抑制し、細胞周期をG1/0期に停止すること[文献9,10]などが明らかとなっている(図2,3)。
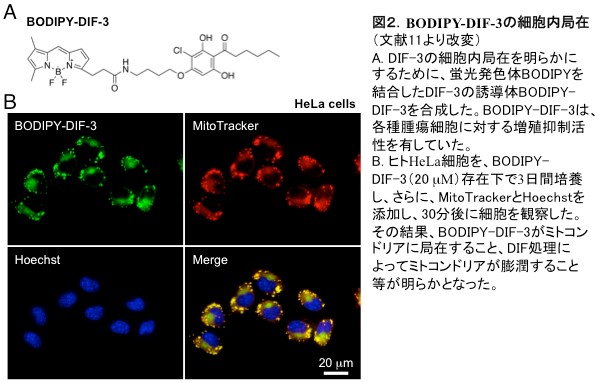
近年、久保原らは、ある種のDIF誘導体がミトコンドリアに作用すること(図2,3)、また、それら誘導体ががん細胞の浸潤・転移を阻害する可能性も示している[文献11,12]。
現在、我々の研究室では、DIFをリード化合物とした新規抗がん剤の開発とDIFの作用機序解析を進めている
[参考文献]
1. Kubohara, K. & Kikuchi, H. Cells 8, 6. (2019).
2. Oka, H.,et al. J. Antibiot. 38, 1100-1102 (1985).
3. Asahi, K. et al. Biochem. Biophys. Res. Commun. 208, 1036-1039. (1995).
4. Kubohara, Y. Eur. J. Pharmacol. 381, 57-62. (1999).
5. Gokan, N. et al. Biochem. Pharmacol. 70, 676-685. (2005).
6. Kubohara, Y. Biochem. Biophys. Res. Commun. 236, 418-422. (1997).
7. Shimizu, K. et al. Cancer Res. 64, 2568-2571. (2004).
8. Kanai, M. et al. Oncogne 22, 548-554. (2003).
9. Takahashi-Yanaga, F. et al. J. Biol. Chem. 278, 9663-9670. (2003).
10. Miwa, Y. et al. Circ. Res. 86, 68-75. (2000).
11. Akaishi, E. et al. Eur. J. Pharmacol. 485, 21-29. (2004).
12. Kubohara, Y. et al. PLoS ONE 8, e72118. (2013).
13. Kubohara, Y. et al. Biochem. Biophys. Res. Commun. 463, 800-805. (2015).
14. Totsuka, K. et al. Biomolecules 9, 256. (2019).
2-2)肥満/糖尿病治療薬の開発
久保原らは、in vitro培養系を用いて、正常細胞に対するDIFsの毒性を検討する過程で、DIF-1(5−20 µM)が正常細胞(Confluent状態)の糖取込み(糖代謝)を促進することを発見した(図1)[文献1–3]。このDIF-1の作用は、ラット胃粘膜RGM-1細胞、マウス3T3-L1細胞、および分化誘導した3T3-L1脂肪細胞において確認された。また、糖取込み促進活性は、「DIF-1
> DIF-2 > DIF-3」の順で高かった。
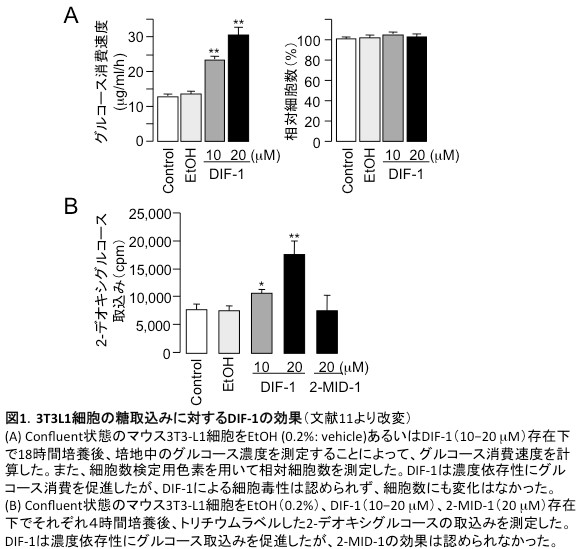
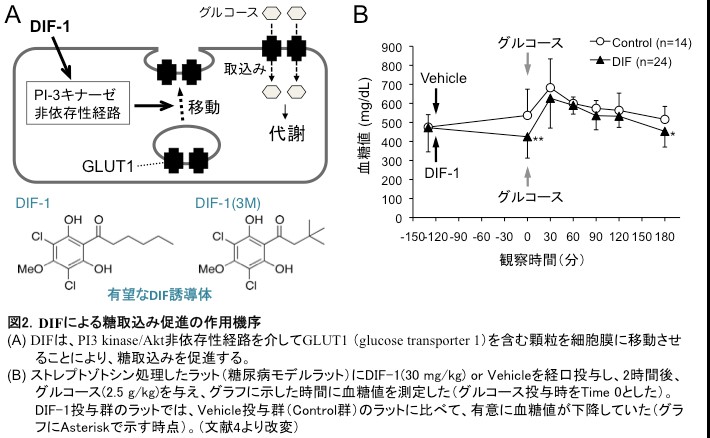
DIF-1の作用機序に関しては、DIF-1による糖取込み促進作用はPI-3 kinase/Akt系を介さないこと(すなわち、インスリンの作用機序とは異なること)や、DIF-1が細胞内GLUT1(glucose
transporter 1)の細胞膜への移行を誘導すること等が明らかとなった(図2A)[文献1]。
さらに、久保原らは、30種類のDIF誘導体を用いて「化学構造-活性相関」を検討し、DIFsの有する抗腫瘍活性と糖取込み促進活性はDIFの側鎖修飾によって分離できる可能性があること、すなわち、DIFsによる糖取込み促進作用と抗腫瘍作用の機序は少なくとも一部異なることなどを示した[文献1]。
最近、久保原らは、DIF存在下で細胞に取り込まれた糖が即座に代謝されること、また、経口投与したDIF-1が糖尿病モデルラットの血糖値を下降させることも示している(図2B)[文献4]。
現在、我々の研究室では、DIF-1をリード化合物とした肥満・糖尿病治療薬の開発とDIFの作用機序解析を進めている。
[参考文献]
1. Omata, W. et al. FEBS J. 274, 3392-3404. (2007).
2. 久保原禅、柴田宏.特許第4534039号「糖代謝促進剤並びに肥満及び糖尿病治療薬のスクリーニング方法」(2010年6月取得)
3. Kubohara, Y. & Shibata, H. US PatentNo: 7,846,974 B2. Method of lowering blood glucose and method of treating
diabetes and obesity.(2010年12月取得)
4. Kawaharada, R. et al. Life Sci. 155, 56-62. (2016).
(註:ここまでの項目は、主に「和光純薬時報80(2),2-6.(2012).総説」を改変して作成)
2-3)免疫制御剤の開発
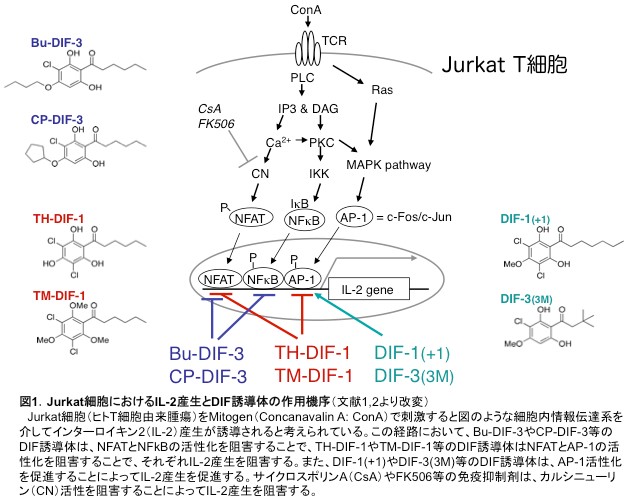
久保原らは、Mitogen刺激したJurkat細胞(ヒトT細胞のモデル)におけるInterleukin-2(IL-2)産生を指標に、各種DIF誘導体の効果を検討し、ある種のDIF誘導体がIL-2産生を阻害し、別のDIF誘導体がIL-2産生を促進することを見出した(図1)[文献1−3]。この成果を基に、我々の研究室では、DIFをリード化合物とした新しい免疫制御剤の開発を進めている。
[参考文献]
1. Takahashi, K. et al. Life Sci. 85, 438-443. (2009).
2. Takahashi, K. et al. Life Sci. 88, 480-485. (2011).
3. 久保原禅、村上正巳、高橋克典、大島吉輝、菊地晴久.特許第5630751号「インターロイキン-2産生抑制剤」(2014年10月取得
2-4)抗トリパノソーマ剤の開発
南米型トリパノソーマ(Trypanosoma cruzi)は、「シャーガス病」とよばれる疾患を引き起こす寄生性の原虫(単細胞生物)で、中南米で1600万人以上が感染し、毎年数万人が命を落としている。本疾患に対する既存薬は、急性期のみに使用されるが、有効性が低く副作用が強い。また、慢性期に有効な薬剤は存在しない。したがって、より有効でヒトへの毒性が少なく、かつ安価な新しい治療薬の開発が求められている。
近年、嶋田(群馬大学保健学科)、大島、菊地(東北大学薬学研究科)、久保原らの研究グループは、南米シャーガス病の治療薬開発を目的として、同病の原因虫であるT. cruziに対するDIF誘導体の薬効を検討した。その結果、ある種のDIF誘導体がin vitro培養系においてT. cruziのホスト細胞への感染と増殖を抑制すること、また、in vivoでの原虫の増殖を抑制することを見出した(図1)[文献1]。DIFの作用機序については未解明である。
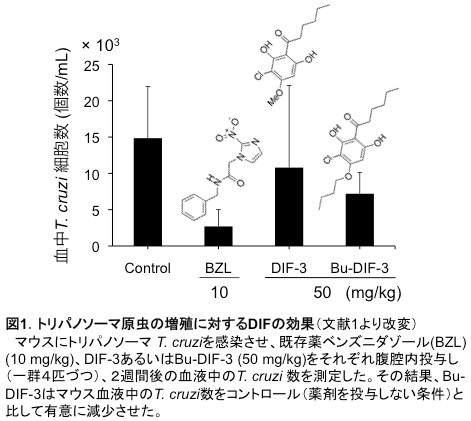
現在、我々はDIFをリード化合物とした新しい抗トリパノソーマ剤の開発とDIFの作用機序の解析を進めている。
[参考文献]
1. Nakajima-Shimada, J. et al. Biochem. Pharmacol. 85, 1603-1610. (2013).
2. 久保原禅、嶋田淳子.特許第5610433号「抗トリパノソーマ剤およびトリパノソーマ症治療薬」(2014年9月取得)
2−5)抗菌薬の開発
ペニシリンの発見以降、真菌や放線菌等の土壌微生物から多くの抗菌薬が発見され、人類に貢献してきた。しかし現在、既存抗菌薬に対する耐性菌が世界中に蔓延し、それらによる感染症が人類の脅威となっている。
近年、我々はグラム陽性菌の増殖に対するDIF誘導体の効果を検討し、一部のDIF誘導体が強力な抗菌活性を有することを発見した[文献1, 2]。いくつかのDIF誘導体は、黄色ブドウ球菌 Staphylococcus aureus(薬剤感受性株/MSSA株)とメチシリン耐性黄色ブドウ球菌(MRSA株)の発育を強力に阻害した(図1)。我々の用いたMRSA株は、ペニシリンとストレプトマイシン以外にも、イミペネム、レボフロキサシン、クリンダマイシン等の抗菌薬に対する多剤耐性を示したことから、それら既存薬とDIFの作用機序は少なくとも一部異なるものと考えられる。
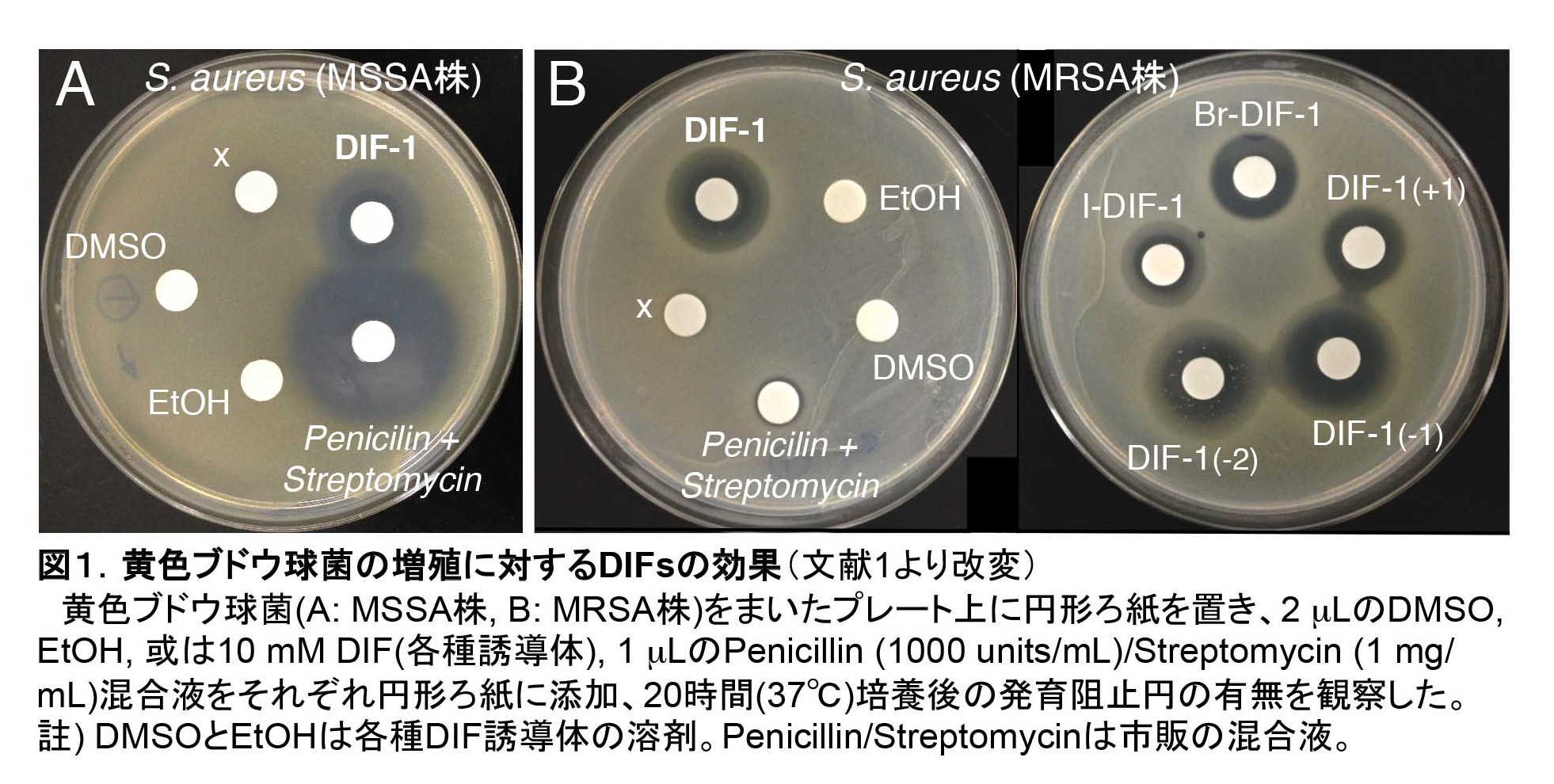
さらに、一部のDIF誘導体は腸球菌Enterococcus faecalis(薬剤感受性株/VSE)やバンコマイシン耐性腸球菌(VRE)に対しても強力な抗菌力を発揮した(表1)。これまでに我々が調べた全てのグラム陽性菌に対してDIFは抗菌活性を有していた[文献1, 2]。
現在、我々はDIFをリード化合物とした新しい抗菌薬の開発とDIFの作用機序の解析を進めている。
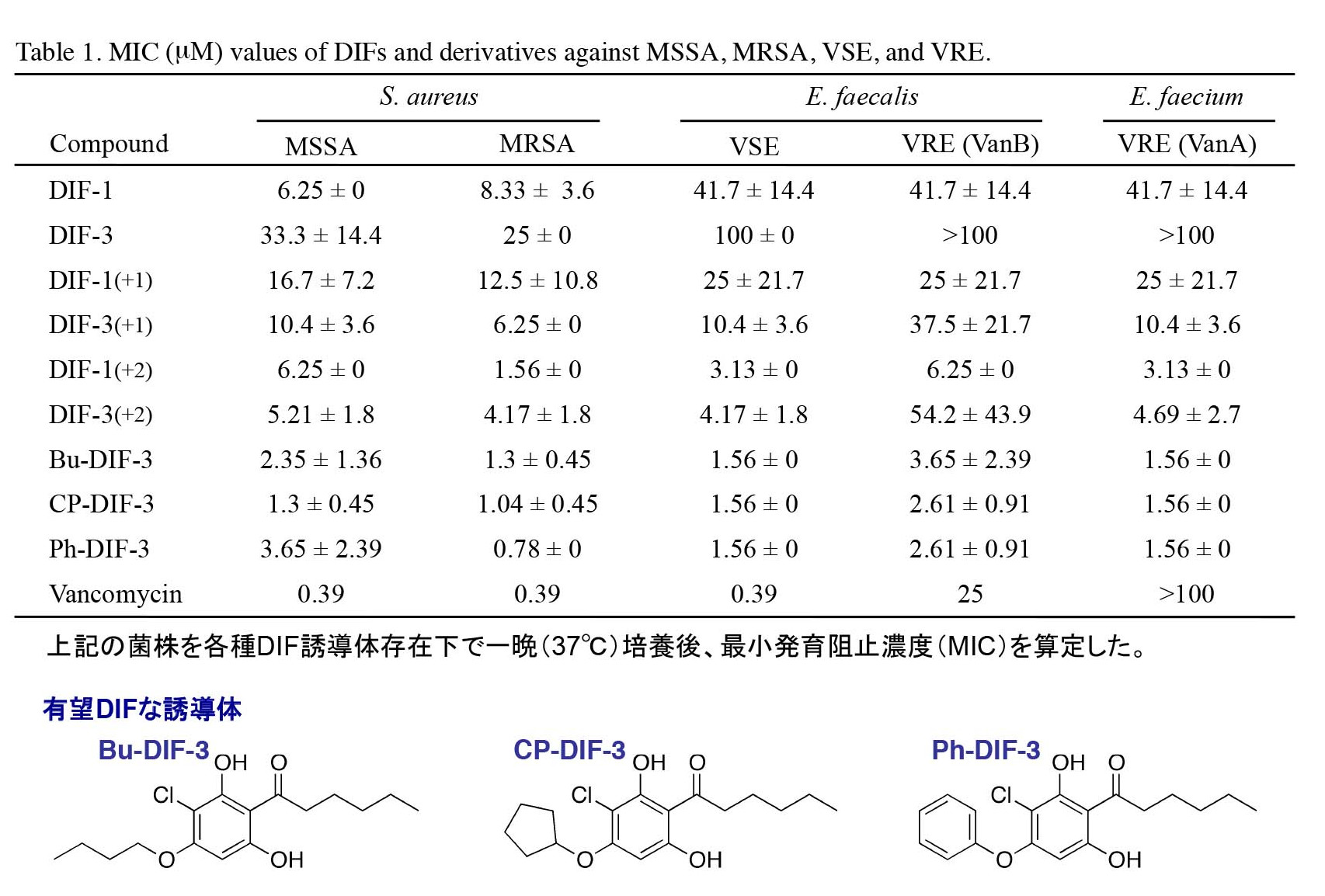
[参考文献]1. Kubohara Y, Shiratsuchi Y, Ishigaki H, Takahashi K, Oshima Y, &
Kikuchi H. Antimicrobial activities of Dictyostelium differentiation-inducing
factors and their derivatives.
Biomolecules9, 163. (2019).2. 久保原禅、菊地晴久、大島吉輝.特許第6478378号「抗菌剤」(2019年2月取得)
2−6)細胞性粘菌由来の新規生物活性物質の研究
東北大学大学院薬学研究科の研究グループは、これまで細胞性粘菌由来の多くの新規生物活性物質(低分子物質)を単離、同定している(図1はこれまでに単離された化合物の一部)[文献1–3]。
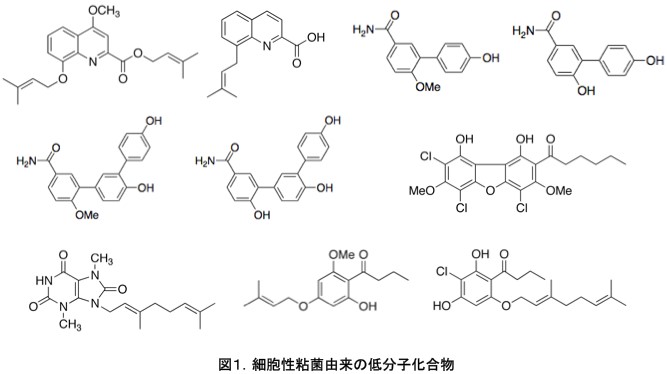
これらの化合物は様々な生物活性を有しており、東北大学と我々の研究グループは、これらの物質をリード化合物とした新たな薬剤開発を模索している。
[参考文献]
1. Kikuchi, H. et al. Tetrahedron 66, 6000-6007. (2010).
2. Kikuchi, H. et al. Tetrahedron 68, 8884-8889. (2012).
3. Kikuchi, H. et al. Bioorg. Med. Chem. 21, 4628-4633. (2013).
2-7)私たちの研究と健康科学/スポーツ科学との接点
ここで紹介している我々の研究は、基礎医学/薬学/健康科学的なものであり、すべての人々の健康に寄与する研究であることは言うまでもないが、我々の研究はスポーツ科学に(そして、もちろんアスリートにも)貢献できる要素が多い。上記の項目では紹介しきれなかったが、そのキーワードは「筋・神経・骨」である。
たとえば、DIF-1はヒト臍帯血管平滑筋細胞のin vitroでの分化状態の維持や、脱分化した同細胞の再分化を誘導することが示されている[文献1]。また、マウス胚性がん腫細胞はDMSO(dimethylsulfoxide)存在下でin vitro培養をすると心筋様細胞に分化するのだが、DIF誘導体の1つであるBr-DIF-1はDMSOによる心筋分化を強く促進する[文献2]。さらに、粘菌由来のFuranodictine Aという化合物は、ラット褐色細胞腫PC12細胞を神経様細胞に分化誘導することができる[文献3]。骨細胞分化に対する各種粘菌由来化合物の効果は現在検討中である。
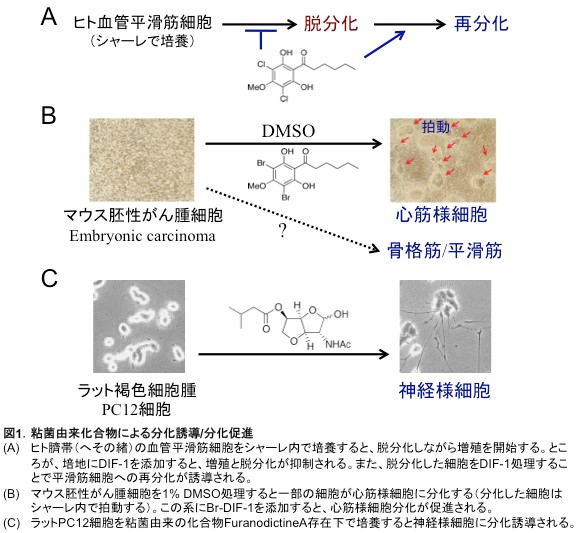
iPS細胞の発明によって、細胞の分化状態を初期化することが可能となり、世界中の研究者がiPS細胞を用いた再生医療等の研究を進めている。しかしながら、iPS細胞を用いても、自由自在にあらゆるタイプの分化細胞を得ることは現状では難しい。この状況を解決するための1つ手段は新たな分化誘導因子/分化誘導環境(分化誘導技術)の開発と思われる。
細胞性粘菌由来の化合物を利用することによって、将来、iPS細胞等の培養細胞から筋肉(心筋/平滑筋/骨格筋)、骨、神経などを作成することが可能となるかもしれない。スポーツ外傷・スポーツ障害(とりわけ、筋肉/骨/神経系のシリアスな損傷)はアスリートの敵。もし上記のような医療技術が確立すれば、スポーツ中の様々なアクシデントに起因する筋肉や骨、神経の損傷を治療することも可能となるだろう。
[参考文献]
1. Miwa, Y. et al. Circulation Research. 86, 68-75. (2000).
2. Seya, K. et al. Br. J. Pharmacol. 165, 870-879. (2012).
3. Kikuchi, H. et al. J. Org. Chem. 66, 6982-6987. (2001).
3)重金属に関する生物学的研究
一般的に鉄以上の比重をもつ金属を重金属という。重金属の中には、鉄、亜鉛、銅などのように生物にとって必須の元素もあるが、カドミウムや水銀などのように毒性の強い元素も多い。また、生物に必須な元素であったとしても、必要量以上の重金属は生体に悪影響を及ぼすため、環境中の重金属濃度は厳しく管理しなければならない。
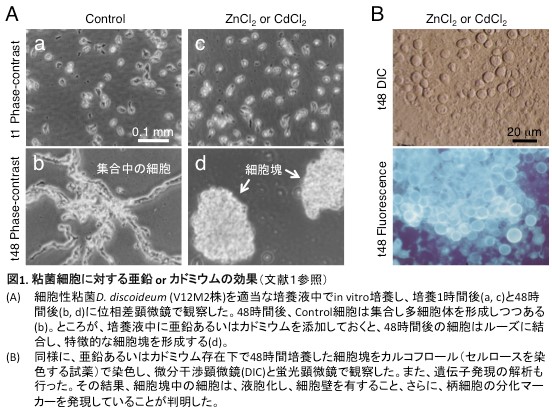
我々の研究室では、粘菌や培養細胞を利用して、種々の生命現象に対する重金属の影響を検討している。重金属に関する研究は広範囲に及び、これまでに、亜鉛やカドミウムが細胞性粘菌の柄細胞分化を誘導すること(図1)[文献1]、亜鉛がヒトT細胞系のJurkat細胞におけるMitogen誘導性のIL-2産生を阻害すること[文献2]、さらに、マンガンがJurkat細胞のフォルボルエステル誘導性のIL-2産生を促進すること[文献3]等を報告してきた。
重金属が細胞分化等に影響を及ぼすメカニズムの詳細は不明だが、我々はそれらの解析を進めている。
[参考文献]
1. Kubohara, Y. & Okamoto, K. Exp. Cell Res. 214, 367-372. (1993).
2. Tanaka, S. et al. Biochem.Biophys. Res. Commun.335, 162-167. (2005).
3. Tanaka, S. et al. Toxicol. Lett. 211, 312-318. (2012).
















