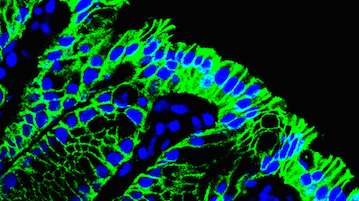
研究内容
自己を外界から隔離することは、生命体がアイデンティティを保つための必須条件であり、そのため我々の体は表皮と粘膜からなるバリアが存在します。なかでも絨毛構造を持つ腸管粘膜はテニスコート1.5面分(400 m2)の面積があり、これは皮膚面積の200倍に相当します。これだけの広さを持つ腸管粘膜は、食餌とともに摂取される病原菌やウイルス、さらには100兆個にも及ぶとされる腸内常在細菌に曝されていることから、常に感染や炎症の危険と隣り合わせにあります。粘膜に沿って並んでいる一層の腸上皮細胞は、栄養素の吸収という生命維持に不可欠な機能を司る一方で、病原体の侵入を防ぐというバリア機能の中心を担っています。腸上皮細胞は堅牢なタイトジャンクションを形成し、体の内と外を隔てる物理的障壁となるのみならず、分厚いムチン層の形成や抗菌ペプチドの分泌などを介して、積極的な宿主防御の役割を果たしています(図1)。ところが病原微生物の中には積極的に上皮バリアを破って体内侵入する手段を獲得したものや、上皮層のなかで最もバリア機能が脆弱なパイエル板M細胞を標的として侵入するものが存在します(研究テーマ1)。
近年の研究から、腸上皮バリアの破綻は、粘膜免疫系の制御異常を引き起こし、炎症性腸疾患、食物アレルギー、経粘膜感染症など多種多様な疾患の発症や進展に関わることが示唆されています(研究テーマ2)。このような生物学的重要性にも関わらず、上皮バリアの構築メカニズムについては不明な点が多く残されています(研究テーマ3)。上皮バリアと粘膜免疫系は密接に連携していることから、これら2つの研究領域を統合的に解析することで、生命恒常性維持機構としての粘膜バリアシステムの理解をめざし粘膜バリア学(Mucosal Barriology)(※注1)研究を推進しています。現在、主として下記に示す3つの研究テーマに取り組んでいます。
※注1:バリオロジー"Barriology"とはもともと、タイトジャンクションの構成蛋白質を同定された故・月田承一郎教授(京都大学大学院医学研究科)が提唱された日本発の概念/造語で、多細胞生物におけるバリアのサイエンスを表しています。
1.特殊上皮M細胞による抗原トランスサイトーシス機構の解明
腸管粘膜は、食物に含まれる種々の微生物や常在細菌に曝されています。これらの外来抗原を絶えず監視し、免疫応答を適切に誘導することは重要な生命維持機構の一つです。腸管にはこのような『免疫監視』の実働部隊として多数のリンパ球が集まり、生体内で最大の免疫系を構築しています。しかしながら、粘膜面の抗原を絶えずモニターするためには、上皮バリアを超えて抗原の一部をパイエル板などの粘膜関連リンパ組織に取り込む必要があります。その中心的な役割を担うのは、パイエル板上皮層に存在するmicrofold(M)細胞です。M細胞には、管腔側に存在する抗原を取り込み、リンパ濾胞に面した側基底面に輸送する『抗原トランスサイトーシス』と呼ばれる細胞内輸送の仕組みが発達しています。しかしながら、その分子基盤については、細胞の発見から約40年近く手つかずのままでした。
私達はこれまでに、M細胞に強く発現するGlycoprotein 2 (GP2)という膜蛋白質が、サルモネラ菌などI型線毛を有する細菌の取り込みを促進することを明らかにしました(Nature 2009 ![]() )。GP2遺伝子欠損マウスでは、サルモネラ菌に対する粘膜免疫応答が起こりにくくなることから、GP2を介した菌体の取り込みが抗原特異的な粘膜免疫応答の発動に重要な役割を果たすことを証明しました。その一方で、赤痢菌やなどその他多くの病原体に対する受容体や、細胞内輸送の仕組みについて未だ不明な点が多く残されています。そこで本研究ではM細胞に発現する病原体の受容体と細胞内輸送に関わる分子群の同定を試みます。さらにはM細胞に発現する抗原取り込み分子を標的としてワクチンをデザインすることで、安全かつ効率的な“粘膜ワクチン”の開発を目指します(図1)。
)。GP2遺伝子欠損マウスでは、サルモネラ菌に対する粘膜免疫応答が起こりにくくなることから、GP2を介した菌体の取り込みが抗原特異的な粘膜免疫応答の発動に重要な役割を果たすことを証明しました。その一方で、赤痢菌やなどその他多くの病原体に対する受容体や、細胞内輸送の仕組みについて未だ不明な点が多く残されています。そこで本研究ではM細胞に発現する病原体の受容体と細胞内輸送に関わる分子群の同定を試みます。さらにはM細胞に発現する抗原取り込み分子を標的としてワクチンをデザインすることで、安全かつ効率的な“粘膜ワクチン”の開発を目指します(図1)。
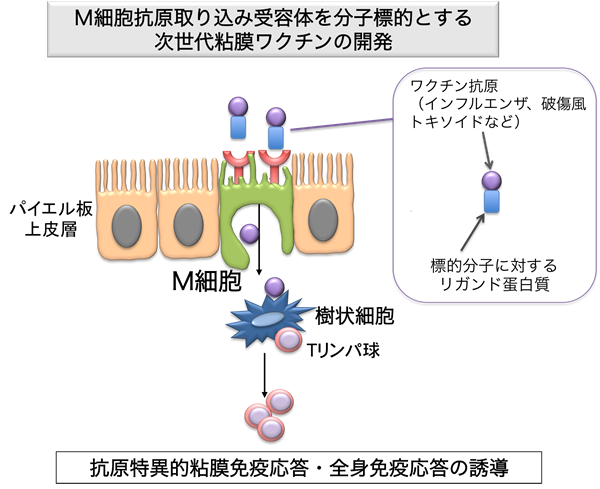
図1
2.腸上皮バリアの破綻による炎症性腸疾患発症メカニズムの解明
腸上皮細胞は、堅牢なタイトジャンクションを形成し、外来微生物に対する物理的なバリアとして機能しています。加えて、腸管上皮細胞の一つである杯細胞が活発にムチン産生することで、粘膜面に分厚いムチン層が形成されます。吸収上皮細胞やパネート細胞は、α-およびβ-defensinsやcathelicidinに代表される抗菌蛋白質を産生することで、細菌の生体内への侵入を未然に防いでいます。腸管の粘膜固有層では、毎日約5グラムの二量体IgAが産生されているが、腸上皮細胞はこの二量体IgAを腸管管腔へ輸送する働きも担っています。このように腸上皮細胞は単なる物理的障壁ではなく、粘膜面の生体防御を担うエフェクター細胞としての役割を担っています。さらには外界の情報(細菌・毒素の侵襲など)を感知し免疫系に伝えるセンサーとしても機能しています。
これらの事実から、上皮バリアは粘膜面における生体恒常性維持に重要な役割を果たすことを示唆しています。実際に上皮バリア機能の破綻は炎症性腸疾患などにおいて認められます。そこで様々な遺伝子改変マウスを用いて、上皮バリア破綻から慢性炎症が発症するまでの病態形成メカニズムについて解析を行うことで、免疫関連疾患の病態解明と治療技術の確立へ向けた分子基盤の構築をめざしています(Gastroenteology 2011 ![]() ; J. Immunol. 2012
; J. Immunol. 2012 ![]() )。
)。
3.腸内細菌によるエピジェネティックな免疫バリア修飾作用の解明
ヒトの体表や粘膜には体細胞の総数を遙かに超える共生菌が定着しており、生命恒常性の維持に重要な役割を果たしています。我々は体細胞と共生菌から形成される「超生命体Superorganism」と呼ぶことができます。特にヒト腸管には100兆個にも達する細菌が棲息しており、これら腸内細菌には、上皮バリア機能を高めたり、腸管免疫系の発達を促したりする作用があります(Nature 2011 ![]() )(図2)。腸内細菌は、食物繊維や難消化性デンプンを活発に発酵分解し、低分子の代謝物を産生します。腸内細菌によって作られる代謝物のなかには、エピジェネティック調節因子が豊富に含まれていることから、『腸内細菌は宿主細胞のエピゲノム状態を変化させることで、腸管免疫系の発達を促している』ことが予想されます。本研究では、共生細菌による免疫エピゲノム修飾機構を明らかにすることで、腸管における宿主−微生物間相互作用の分子メカニズムを明らかにしたいと考えます。
)(図2)。腸内細菌は、食物繊維や難消化性デンプンを活発に発酵分解し、低分子の代謝物を産生します。腸内細菌によって作られる代謝物のなかには、エピジェネティック調節因子が豊富に含まれていることから、『腸内細菌は宿主細胞のエピゲノム状態を変化させることで、腸管免疫系の発達を促している』ことが予想されます。本研究では、共生細菌による免疫エピゲノム修飾機構を明らかにすることで、腸管における宿主−微生物間相互作用の分子メカニズムを明らかにしたいと考えます。
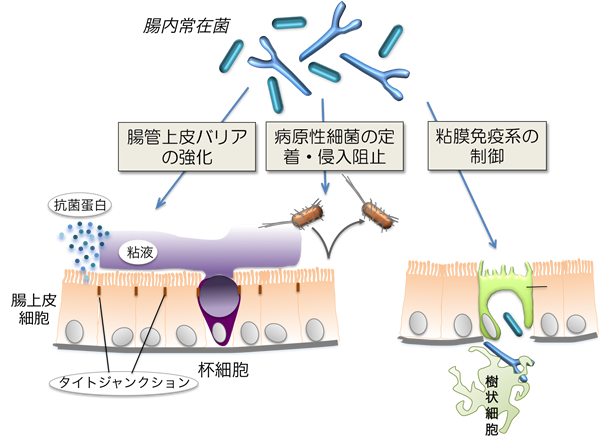
図2