トランスレーショナル・リサーチ(TR)とは
トランスレーショナル・リサーチ(TR)=橋渡し研究とは、研究者が薬剤や器具を用いて行ってきた基礎研究成果を、新たな疾患の予防や治療、診断等として人に使用(臨床応用)できるようにするために行う研究です。
基礎研究の成果を用いて人を対象とした研究を実施するためには、その薬剤や器具等を人に使用することが科学的、倫理的に妥当であることを、実験動物等を用いた非臨床試験も含めた基礎研究段階において、適切に確認しておくことが重要となります。特に遺伝子治療や再生医療といった先端生命科学研究においては、これまでの知見では効果や安全性を予測することが困難な場合があり、臨床応用の妥当性、安全性について規制当局も交えて十分な検討を行う必要があります。また、臨床応用に際しては被験者の権利の尊重や説明責任といった倫理的配慮も不可欠です。
TRとは、こういった基礎研究段階から臨床応用への円滑な移行を担う新しい分野です。
TRでは基礎及び臨床研究者、生物統計家、リサーチ・ナース、データマネージャなど様々な職種の専門家が協力して研究を遂行します。
業務案内
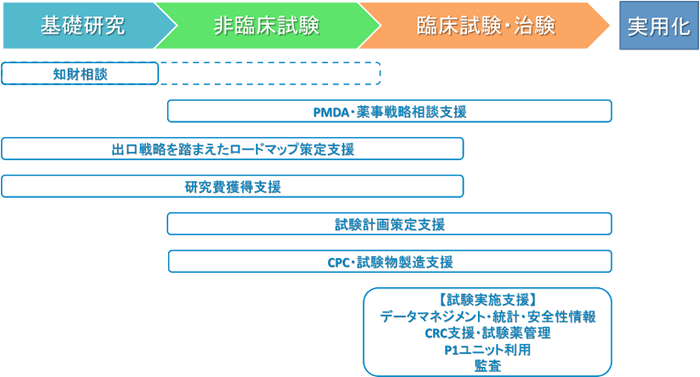
東大病院には、主に非臨床試験~臨床試験開始準備段階までを支援するトランスレーショナル・リサーチセンター(TRセンター)と、主に臨床試験の支援を行う臨床研究支援センターがあります。また、シーズ探索にあたってはURA(リサーチアドミニストレーター)と連携をしています。さらに医科学研究所附属病院、株式会社東京大学TLO、その他学内の様々な研究講座(疫学保健学講座、臨床試験データ管理学講座等)との連携により、幅広い領域における支援を可能としています。シーズ開発のいずれの段階においても、各研究にとって必要な支援を行っています。
●非臨床段階
- 安全性評価試験における評価項目の検討、試験方法の検討など
- 安全性評価試験(無菌試験、マイコプラズマ否定試験、エンドトキシン試験)の実施(医科学研究所 安全性検証室)
- 試験物製造支援(cGMP準拠のCPC)
- PMDA薬事戦略相談の申請資料作成支援、面談への同席等
●臨床試験準備段階
- プロトコール、症例報告書等作成支援
- 薬事戦略相談、治験相談、先進医療等の申請書類作成支援、面談への同席等
主に以下のようなご相談をお受けしています
| 試験物製造関連 | ◇臨床試験までに実施すべき試験項目および方法 ◇人に投与できる品質の細胞製剤の調製 |
|---|---|
| 規制対応 | ◇薬事戦略相談・先進医療・治験等の申請資料の作成方法 ◇厚生労働省・PMDA等での面談への同席 |
| 試験計画 | ◇試験デザインの構築 ◇試験実施計画書、症例報告書等の作成 ◇多施設共同試験の実施体制の構築 |
| その他 | ◇知財に関する相談 ◇実用化を目指した試験の進め方 |
上記以外にも、シーズ開発の支援についてご検討の際は、お気軽に以下までお問い合わせください
東京大学医学部附属病院 トランスレーショナルリサーチセンター
E-mail : TRC@h.u-tokyo.ac.jp
これまでの支援実績(平成26年4月1日時点)
| CPCにおける再生医療プロジェクト受け入れ | 東大内部1件、外部2件 |
|---|---|
| 臨床試験実施支援 | 3件 |
| 治験相談支援(資料作成、面談同席等) | 医師主導3件、企業1件 |
| 先進医療申請支援(資料作成、面談同席等) | 3件 |
| 実施計画書等作成支援 | 先進医療1件、医師主導治験3件 |
| 多施設試験実施ネットワーク構築支援 | 先進医療1件 |
| 医工連携支援 | 2件 |
| 試験物の品質・安全性に関する検討 | 6件 |
| 薬事戦略相談支援(資料作成、面談同席等) | 14件 |
| ヒト幹細胞臨床研究指針承認 | 3件 |
| 遺伝子治療臨床研究指針承認 | 1件 |


