支援利用者インタビュー
がん放射線治療を進化させる
〜新しい標的アルファ線治療法開発研究の現場から〜
長谷川 純崇
国立研究開発法人量子科学技術研究開発機構・量子医科学研究所・
放射線がん生物学研究グループ・グループリーダー
がんの細胞を体内から放射線で狙い撃ち
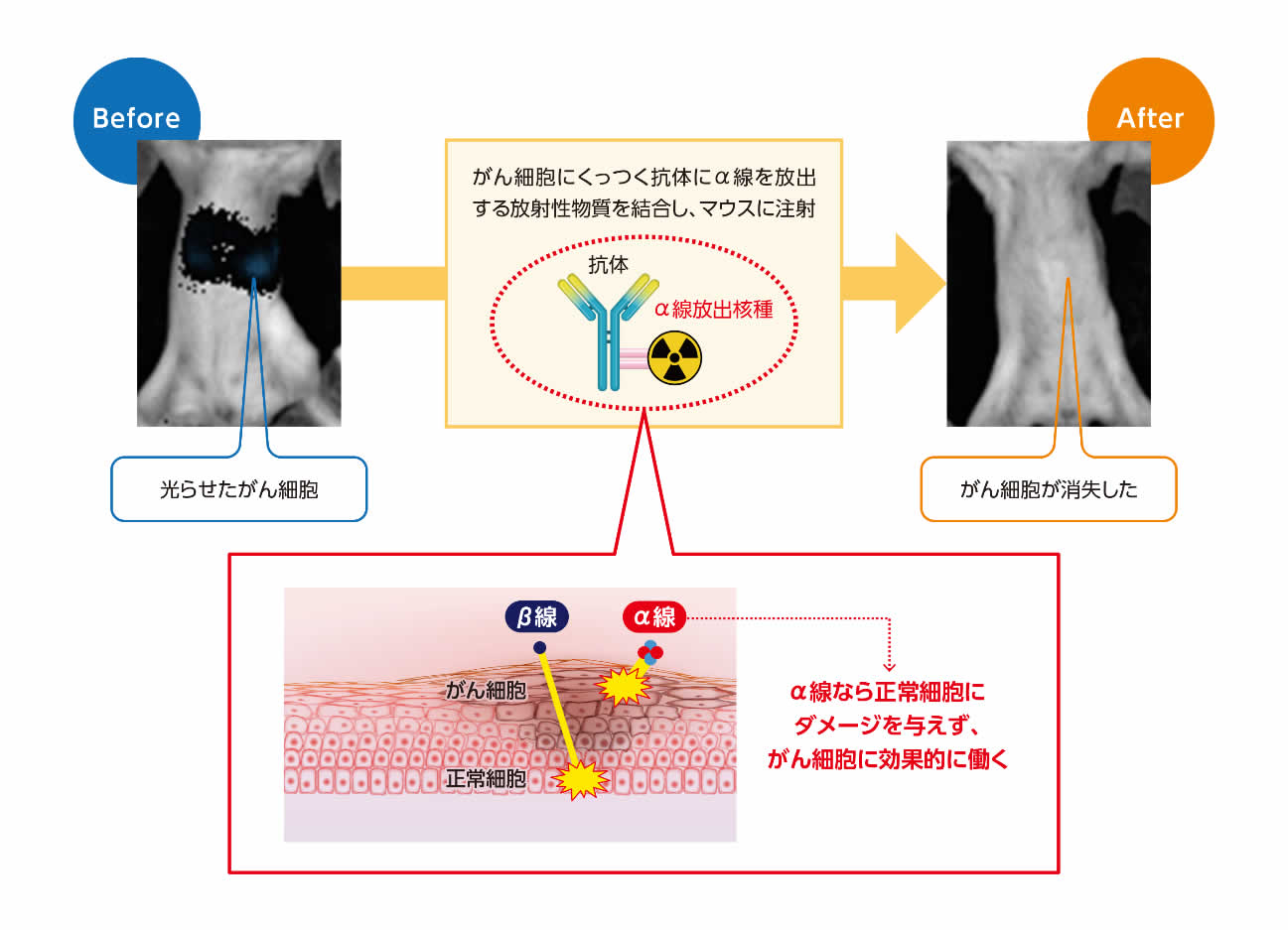
がんで国内では年間約34万人(2020年)も亡くなっており、1981年からずっと死因第一位の座を占めている。治療法の開発は医学・生物学研究の大きなテーマで、外科手術や抗がん剤とならんで、柱の一つとして放射線治療がある。放射線治療はもともと他の治療より体への悪影響が少ないことが利点とされているが、従来のエックス(X)線を用いる方法より、さらに患者の負担が小さい方法、例えば患部に局所的に照射できる粒子線を使った方法などの実用化が進められている。その中でも、国立研究開発法人量子科学技術研究開発機構・量子医科学研究所の長谷川純崇グループリーダーは、がん細胞を特異的に認識する抗体に放射性物質をくっつけて、その抗体を体内に送り込み、がん細胞だけに放射線を照射する放射免疫療法と呼ばれる方法を研究している。

現在注目されているのは、アルファ(α)線を出す放射性物質を使った治療だ。ベータ(β)線を放出する放射性物質を使った場合に比べて、α線は切れ味が鋭いのが特徴だという。β線は、放射性物質から数ミリメートル程度まで離れた細胞まで到達するのに対し、α線が到達するのは50から100マイクロメートル程度で、β線の10分の1ほどしかない。哺乳類の細胞の大きさにすれば2、3個分の範囲にしか放射線が届かないのだ。
「細胞数個ぐらいの距離で止まる。その範囲で、大きなエネルギーを放出してDNAを壊して細胞を殺す。局所での効き目は抗がん剤に比べてとても大きいです」と長谷川氏。
威力が大きいので、標的にしている臓器以外に悪影響を及ぼさないかなどの確認が進められていた。2016年には、α線を使った初の治療薬「ゾーフィゴ」が治療の難しい前立腺がん向けに承認されるなど、安全性も確保できる見通しがつき、研究がさらに加速している。
長谷川氏らは「ハーセプチン」など、すでに市販されている抗体医薬品に放射性物質をくっつけることで、治療効果をさらに高める研究も進めている。
「がんが局所に収まっていて画像診断できる場合は、体の外から粒子線などを照射して治療する。一方、転移したり体の中で散らばったりしていて画像診断で見えないようながんには放射免疫療法という形で使い分け、すべてのがんを放射線で治せるようになるかもしれません」
図:α線を使った放射免疫療法(マウスの画像:量子科学技術研究開発機構より提供)
治療効果の検証に不可欠な病理の目
放射性物質を作り出すためのサイクロトロン(加速器)や、分子生物学の最先端の方法などを駆使して研究しているが、研究はそれだけでは進まないという。「治療の効果を調べるには、古くからの病理学的な手法による解析の力は、今も大きい」と長谷川氏は話す。
研究では、ヒトのがん細胞をマウスに移植して治療効果を調べている。がん細胞に特異的にくっつく抗体に放射性物質のアスタチン211を結びつけたものを注射する。抗体はがん細胞に結合し、アスタチン211から放出されるα線が、直近のがん細胞を殺す。その効果を、β線を出す放射性物質を結びつけた抗体と比較した。
病理学的な方法による観察によると、α線では、がん細胞にはすぐに影響が及んでいたものの、直近にある血管には悪影響は出ていなかった。「予想を超えたシャープな切れ味でした」と長谷川氏は話す。
こんな形で研究に不可欠な「病理の目」だが、「顕微鏡で組織を見て、この細胞は正常なのか、少し機能不全を起こしているのか、もう死にかけているのか、そういう判断は、やはり病理の専門家でないと難しい」と言う。
顕微鏡で細胞の顔つきや特性を一個一個見分け、その変化が起きた原因を突き止めていくのに、何年も専門のトレーニングを積む必要があるからだ。医学や生物学の研究者なら誰でも習得できるわけではない。
「医学部の学生のころ、組織の切片を顕微鏡で見て診断するのは、とても古くさい学問だなと思って、分子生物学など最先端の学問があるのに病理の役割は何なのかと先生に尋ねたことがあります。『標本を見ることによって時間的な経過も追えるし空間的な情報もとらえられる。分子生物学や生化学とは違うツールだ』という答えでした。確かに時空間的にものを見ることを考えれば標本を見るというのは非常に存在意義があり、なかなか代替ができない手法なんだと教えられ、感激した覚えがあります」

病理専門家によるプラットフォームの力
とはいえ研究室に病理の専門家を抱えておくのは難しい。そこで長谷川氏らは、先端モデル動物支援プラットフォーム(AdAMS)の病理形態解析支援を利用した。良かった点の一つは、担当の神田浩明・埼玉県立がんセンター病理診断科部長が、量子医科学研究所まで出張して来てくれたことだという。費用もAdAMS側の負担だった。
通常の研究ならば、病理の標本を作ったり、あるいはマウスのがんをホルマリン漬けにしたりして専門家に送って、診断してもらう。しかし長谷川氏らの研究では、組織がα線を出す放射性物質を含んでいるため、標本を施設の外に送ることが難しい。
そこで神田氏が量子医科学研究所に足を運び、その建物の中で顕微鏡で病理の標本を見て、長谷川氏らと対面でディスカッションした。「例えばこういう病理を見たいのであれば、こういう染色法がありますよ、こういう抗体を使ったらどうですかとか、こういうタイミングでサンプリングをすればより詳しい解析ができますよ、など病理解析に関して豊富な手段の提案をいただけました」
また、従来の共同研究のように一対一の共同研究と異なり、神田氏だけでは対応が難しいことがあっても、AdAMSの他の病理専門家先生に知恵を借りて、幅広い支援を受けられるのも利点だという。「病理に関してはこのプラットフォームを超えるような集団や人脈は望めません。そういう手助けがないと、これからの研究は質が上げられないでしょう」と長谷川氏は言う。
「病理についてノウハウもないし、身近にできる人もいない、そもそもどこから始めていいかわからない、どういうサンプルを作っていいのかわからないという段階でも、自分が知りたいことやりたいことを率直にAdAMSに投げかけて相談すればいいでしょう」と利用を勧めている。
(2022年1月5日インタビュー)
*感染対策を行い、取材・撮影を行いました。
 長谷川 純崇(はせがわ・すみたか)
長谷川 純崇(はせがわ・すみたか)
国立研究開発法人量子科学技術研究開発機構・量子医科学研究所・放射線がん生物学研究グループ・グループリーダー
1996年 長崎大学医学部医学科卒業。2001年 長崎大学大学院医学研究科修了(医学博士取得)。2002年より米国カリフォルニア大学ロスアンゼルス校、スタンフォード大学にて博士研究員。2005年より独立行政法人放射線医学総合研究所(現国立研究開発法人量子科学技術研究開発機構)研究員やサブリーダーを経て、2016年より現職。