多細胞構築研究室


発表論文


Wntシグナルは非対称分裂時に非対称な微小管の制御を介してβ-cateninの非対称な核局在を形成する 杉岡賢史、澤斉 細胞工学 30, 1294-1295. (2011)
受精卵から個体が発生するまでには、多様な種類の細胞が作られる必要がある。非対称分裂は1つの細胞から2種類の異なる性質の細胞を作る機構である。線虫C. elegansの非対称分裂はWntシグナルによって制御される。通常のWntシグナル経路と異なる点は、Wnt経路の因子が細胞内で非対称に局在する点である(1, 2)。細胞がWntタンパク質を認識すると、受容体であるFrizzled、下流の因子であるDishevelledは細胞の後ろ側の表層に局在し、β-catenin, APC (adenomatous polyposis coli)は細胞の前側の表層に局在し“細胞表層の非対称性”が形成される(図1-②)。細胞分裂が終期に入り核膜が再形成されるとβ-cateninが後方の核に、転写因子TCFが前方の核に局在し、“核局在の非対称性”を形成する(図1-③)。そして前後の娘細胞の核内で遺伝子の転写が非対称に制御され、異なる運命を持つ二つの細胞が形成される(図1-④)。これまでに我々は“細胞表層の非対称性”が“核局在の非対称性”を制御することを明らかにしていたが、具体的な機構は不明であった(3)。
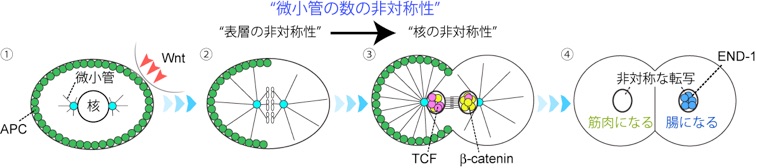
線虫4細胞期胚のEMS細胞は①隣の細胞からのWntシグナルを受け取り、②分裂期に入ると表層のAPCなどが非対称に局在する。③分裂終期に核膜が再形成されると β-cateninやTCFは非対称に核に局在する。④この核の非対称性によって、腸になるために必要な遺伝子end-1が後ろ側の細胞でのみ発現する。
本研究では、②から③への変換に微小管の非対称性が重要であることを示した。
今回我々はWntシグナル経路の因子APCが微小管結合タンパク質でもある点に注目し、微小管が表層から核へのシグナル伝達を仲介しているのではないかと予想した。微小管重合阻害剤で処理すると、核局在の非対称性が失われたことから、核局在の非対称性が微小管依存的に形成されることが示された。微小管の様子を詳細に観察すると、非対称分裂時に星状微小管の数が前側の極では多く、後ろ側の極では少なく、非対称になることが分かった。この“微小管の数の非対称性”はWntシグナルによって制御されており、APCを含むWnt経路の変異体では非対称性が失われる。星状微小管の数は中心体から微小管が生える活性 (nucleation)と微小管の安定性によって決まる。微小管のプラス端に結合するGFP::EB1を用いて微小管の動態を解析したところ、非対称分裂時には、nucleationの頻度や伸長速度ではなく、微小管先端が細胞表層に滞在する時間が非対称になり、前側で長く後ろ側で短くなった。そして、apc(RNAi)では前側の微小管先端の滞在時間が短くなり、非対称性は失われた。APCは細胞表層で微小管の先端と共局在していることから、APCが微小管の先端を表層で捉えることで、先端での微小管の収縮を抑制し、結果として細胞の前側の微小管が安定化されて数が多くなったのだと考えられる。このことから、細胞外のWntシグナルにより、APCを介して微小管の数が非対称に制御されることが明らかとなった(7)。
では、微小管の数の非対称性が非対称な運命決定に必要なのだろうか?我々はまずwnt(RNAi)における微小管の非対称性の異常と非対称な転写活性の異常の関係を解析し、両者の間には強い相関関係があることを見いだした(図2-A)。微小管の数の非対称性が重要であることを証明するためには、人為的に微小管の数を変化させる必要があったため、レーザーを用いて前側や後ろ側の中心体を破壊し、微小管の数の非対称性を消失あるいは増強させた後に核局在の非対称性への影響を解析した。すると、微小管の非対称性を失わせたときには核局在の非対称性が失われ (図2-B)、微小管の非対称性を増強したときには核局在の非対称性も増強された。さらに、微小管の非対称も核局在の非対称性も失われるwnt変異体で後ろ側の中心体を破壊して微小管の非対称性を人為的に創出すると、核局在の非対称性が形成された(図2-C)。以上のことから、“微小管の数の非対称性”によって“核局在の非対称性”が制御されることが明らかとなった(7)。
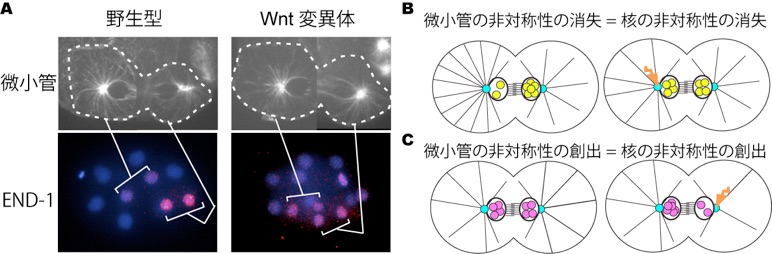
A: 野生型とwnt(RNAi)における分裂終期の微小管(上段:GFP:: β-tubulin)とEND-1レポーター(下段)の発現。野生型では微小管の数が非対称でEND-1は後ろの娘細胞でのみ発現する(写真では一回分裂後)が、wnt(RNAi)では微小管の数が対称になった場合end-1の発現が見られなくなる。青色はDNA。B, C: レーザーによる中心体の破壊実験 (本文参照)
今回我々は、非対称分裂機構の解明に留まらず、シグナル伝達一般に適用しうる知見を得た。これまでにp53などが微小管に結合し、ダイニンモータータンパク質によって核へと移行することで遺伝子発現が制御されることが知られていた(4, 5)。一方で、微小管が細胞外シグナルによって制御されることも知られていた(6)。しかし、両者のつながりは今まで示されてこなかった。本研究は、細胞外からのシグナルが微小管の制御を介して核内の遺伝子発現を制御するという仕組みを初めて明らかにした(7)。
文献
1. Mizumoto K, et al: Trends Cell Biol (2007) 17:465-473
2. Phillips BT, et al: Dev Cell (2009) 17: 27-34
3. Mizumoto K, et al: Dev Cell (2007) 12: 287-299
4. Roth DM, et al: Traffic (2007) 8: 673-686
5. Giannakakou P, et al: Nat Cell Biol (2000) 2: 709-717
-
6.Gundersen GG, et al: Curr Opin Cell Biol (2004) 16: 106-112
-
7. Sugioka K, et al: Cell(2011)146:942-654

Copyright (C) 2010 NIG Multicellular organization lab. All Rights Reserved.


