![]()
はじめに
プロスタグランジンは、生体膜の構成成分であるアラキドン酸を基質として、シクロオキシゲナーゼ(COX)を律速酵素として産生される最も代表的な生理活
性脂質です。(アラキドン酸から各プロスタグランジンの産生される様式を図1A/Bに示します。シクロオキシゲナーゼ経路により産生される生理活性脂質
は、4種類のプロスタグランジンPGE2、PGD2、PGF2α、PGI2とトロンボキセンA2であり、厳密にはこれらを総称してプロスタノイドと呼びま
す。)

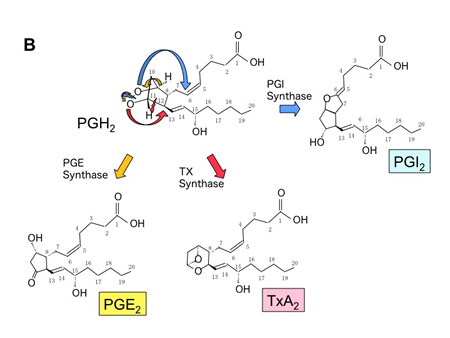
図1
脂質メディエーターが他の細胞間メディエーターと異なるのは、産生されると蓄積されずに速やかに細胞外に放出され、その近傍の細胞にのみ作用して生物活性 を発揮することです。これは、脂質が細胞外に放出されると、酸化酵素により酸化されてすぐに不活性体へと変換される(図2)ためであり、活性体が到達する ことのできる範囲が局所に限定されるのです。このことは、打撲の際に、痛みを感じる部位が打ち付けた箇所を中心にその周囲に限局されることからも想像でき るでしょう。打撲による組織破壊を検知してプロスタグランジンが産生され、これが周囲の知覚神経終末を刺激しているのです。全身のさまざまな組織や細胞 で、プロスタグランジンの作用が異なるのは、産生から作用発現までが局所で完結するため、局所ごとに科せられた役割が全く異なり、部位ごとに独立して進化 してきたためです。例えば、PGE2は中枢で発熱をひきおこしたり、末梢の炎症疼痛に関与して、「悪玉作用」を発揮しますが、一方で消化管粘膜の保護作用 を発揮したり、女性の生殖生理プロセスを促して、生体にとって不可欠な「善玉作用」を担っています。アスピリンやインドメタシンをはじめとする非ステロイ ド性の抗炎症薬(NSAIDs)は内因性のプロスタグランジン生合成を阻害して、強力な解熱鎮痛作用を発揮するのですが、一方で、胃腸管障害や生殖毒性な どの副作用を示すのは、プロスタグランジンが組織や状況に応じて善玉としても悪玉としても働くからです。
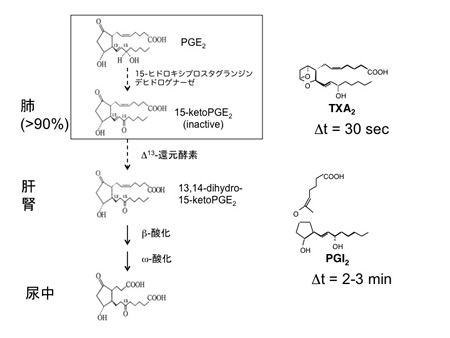
図2.PGの代謝(不活性化)
プロスタグランジンの多彩な生理作用は、標的細胞の膜上に存在する特異的な受容体(GPCR)によって介達されます(図3)。例えば、PGD2の受容体
は、Type D Prostanoid
receptorという意味でDP、同様にPGE2、PGF2α、PGI2、TXA2の受容体をEP、FP、IP、TPと呼びます。中でも、最も代表的な
プロスタグランジン、PGE2には4種類の受容体サブタイプが存在し、EP1、EP2、EP3、EP4と呼んでいます。従って、プロスタグランジンの受容
体ファミリーには、D、F、I、Tに対応する1種類の受容体4種類と、PGE受容体サブタイプの4種類をあわせて計8種類が存在しています。なお、PGの
受容体は、EP1を除いてPGE1とPGE2(5, 6位の二重結合の有無)を区別しないので、PGE受容体あるいはPGD受容体と呼びます。
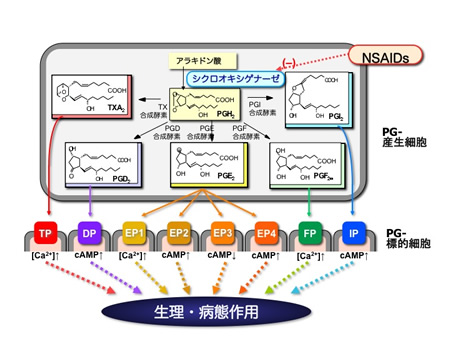
図3.シクロオキシゲナーゼ経路とプロスタグランジン受容体
プロスタグランジン受容体は、リガンドの種類よりも、共役するシグナル伝達系によって構造上のサブファミリーを形成しています(図4)。つまり、4種類の EPサブタイプ同士よりも、Gsに共役してcAMP産生系に働くDP、EP2、EP4、IPの4種類の受容体同士の方が高い相同性を示します。同様に、 EP1、FP、TPは細胞内Ca2+動員系のサブファミリー、EP3のみがGiに共役してcAMP産生抑制系に働き、ファミリーの中では孤立した存在で す。しかしながら、最近では、各PG受容体は発現する細胞によって共役するGタンパク質の種類が異なる場合やGタンパク質非依存生のシグナル経路が活性化 されるケースも報告されていて、さまざまな生理作用に関わる受容体が実際にどのシグナル伝達系を介しているのかについては興味深いところです。 (和文総説:杉本幸彦,「プロスタノイド受容体の発現と機能」生化学, 78、1039-1049、2006、および英文総説:Sugimoto & Narumiya 2007 を参照)
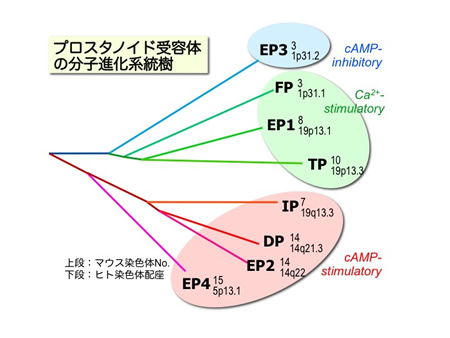
図4.プロスタノイド受容体の分子進化系統樹
私たちは、これまでさまざまなプロスタグランジンの生理作用にどの受容体が関与しているのか(既知PG作用との対応)、を明らかにすることを目標に研究を 進めてきました。このため、生体内のさまざまな臓器でPG受容体の発現細胞を同定して既知作用との対応を図り、PG受容体の欠損マウスを作成しその表現型 を解析することで、各受容体を介したPGの生理・病態作用を明らかにしてきました(過去の研究内容についてはこちらから)。 しかし現在、私たちの興味は、PG受容体がいかにして多彩な細胞内シグナル系を動かすのか(シグナル伝達の分子メカニズム)、PG受容体がいかにして病態 作用や生理作用を発揮するのか(PG作用発現の分子メカニズム)、さらには、PG受容体はどのような未知作用を発揮するのか(新しいPG作用の発見)を明 らかにすることへと移行しています。以下にその例を示します。プロスタグランジンを一つの切り口として、さまざまな部位での生理・病態のプロセスがいかに 巧みに営まれているのか、を明らかにすることを目標にしています。 (和文総説:杉本幸彦, 「プロスタノイド受容体の生理作用発現メカニズム」細胞工学, 26、1231-1235、2007 杉本幸彦,「プロスタノイドの作用発現とシグナル・クロストーク」実験医学,27、2047-2052、2009を参照)
1)プロスタグランジン受容体を用いた構造-活性相関プロファイリング
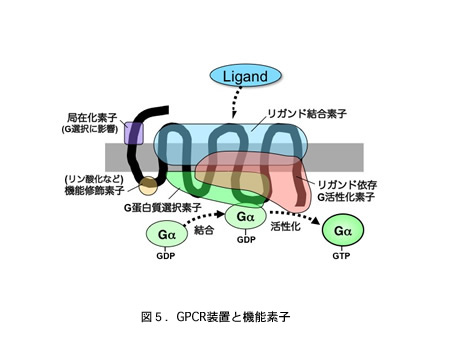
Gタンパク質共役型受容体(GPCR)は、細胞外からの刺激を細胞内へ伝える多機能処理装置として働きます。このGPCR装置は、(1)リガンド選択性素
子、(2)G蛋白質選択素子、③リガンド依存的G活性化素子、(3)リン酸化などによる機能修飾素子、さらには(4)細胞内局在化素子といった受容体の機
能を決定する部位(機能素子)をその構造に内包しています(図5)。しかしこれらのほとんどは未だその実体が不明であり、機能素子同士がどのように影響し
合うのかについても不明な点が多いのが現状です。
私たちは、8種類のプロスタグランジン受容体が特有のGPCRサブファミリーを形成すること、本GPCRファミリーは異なるG蛋白質選択性のGPCRを
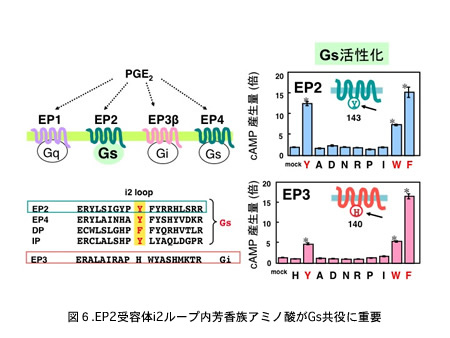
含むことに注目し、プロスタグランジン受容体がG蛋白質シグナルを司る機能素子を探索するよいモデルになると考えました。実際、近年私たちは、EP2受容
体のG蛋白質選択素子((2))として細胞内第2(i2)ループに存在する芳香族アミノ酸クラスターがGsとの共役を決定していること、またEP3受容体
の相同部位に芳香族アミノ酸を導入するとEP3受容体は本来有するGi共役能はそのままにGs共役能を獲得することを見いだし、リガンド選択性を保ちつつ
異なるG蛋白質選択素子が単一受容体に共存しうることを示しました(Sugimoto et al.
2004)(図6)。現在、さらにEP2受容体のi2ループの芳香族アミノ酸とGsとの相互作用を検討しています。さらには、PG受容体の細胞膜上での局
在性やSequestration(細胞中へ取り込まれる現象)、PI3-KなどG蛋白質を介さないシグナリングに関わる機能素子とその性状について検討
しています。
2)プロスタグランジンによる神経作用の分子機構
プロスタグランジンは、中枢神経系では発熱や痛覚過敏の他、病的睡眠や ACTH
などの神経内分泌の促進を引き起こします。これら急性応答のみならず、プロスタノイドはまた、海馬シナプス伝達の長期増強(LTP)や長期抑圧(LTD)
の誘導、あるいは神経活動依存的遺伝子発現においても重要な調節因子として働きます。さらに近年、PGE2がグルタミン酸によるスパイン形成を増強するこ
とが報告され(Amateau et al.
2004)、PGがシナプス可塑性形成に深く関わることがわかってきました。しかしこれらPGの神経作用の中で、そのメカニズムと意義の全貌が解明された
例はほとんどありません。
私たちはこれまで、EP3受容体
が体温中枢と呼ばれる視索前野にEP3が豊富に発現することを示し(Sugimoto et al.
1994)、さらに炎症性発熱に関与する(Ushikubi et al.
1998)ことを見出しました。また最近、EP3受容体のコンディショナル欠損マウスを用いて、視索前野に存在するEP3受容体がPGE2発熱応答を介達
することが示されました(Lazarus et al.
2007)。そこで私たちは、PGE2-EP3受容体による発熱の分子機構を明らかにするため、体温中枢の存在する視索前野のEP3受容体発現ニューロン
を単離し、その遺伝子発現プロファイルがPGE2投与でどのように変化するか解析しました。その結果、GABAA受容体の発現レベルがPGE2処理により
低下することを発見しました(図7)。GABAは脳内の主要な抑制性神経伝達物質であり、GABAA受容体は5つのサブユニットからなるチャネル型の受容
体です。近年、GABAシグナルが体温調節に関わることが示され(Osaka
2004)、PGE2による発熱がこのGABAシグナルによる体温調節系に作用している可能性が考えられました。実際、視索前野におけるEP3受容体と
GABAAの共存を解析したところ、EP3発現細胞の75%がγ2サブユニットを、86%がα2サブユニットを共発現していました(図8A)。PGE2-
EP3によるGABAA遺伝子の発現低下が視索前野単位で観察されるか調べたところ、PGE2脳室内投与30分で野生型では視索前野のγ1、γ2、α2の
発現レベルが減少しましたが、EP3欠損マウスではそのような変化は見られませんでした(図8B)。さらに視索前野でのGABAA
α2タンパク質発現を調べたところ、PGE2投与によりGABAAα2発現量が有意に低下しました。以上の結果から、PGE2が視索前野ニューロンの
EP3受容体に作用すると、GABAAサブユニットの組成を低下させ、本ニューロンのGABA抑制支配を変化させることが発熱に繋がるものと考えられまし
た。
現在さらに、PGによる脳の性分化やニューロン形態の制御などを題材として、中枢シナプスネットワーク調節とその作用機序を調べています。
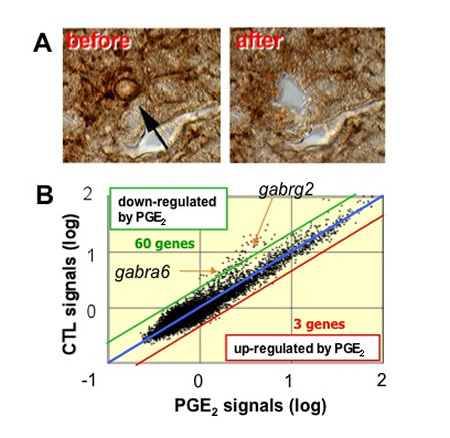
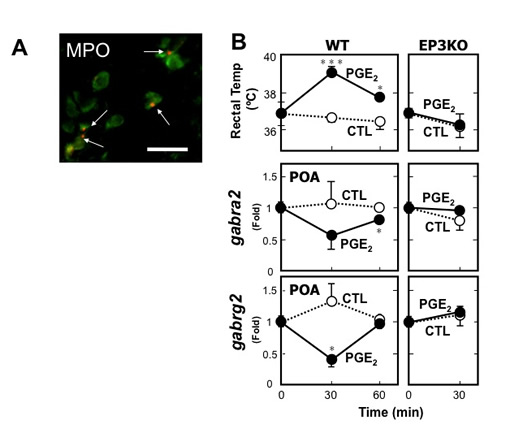
| 図7.EP3発現ニューロンのシングルセル発現プロファイル解析。A.視索前野EP3陽性ニューロンのパンチアウト。B.マイクロアレイ解析の結果、PGE2刺激で二種類のGABAA遺伝子(gabra6, gabrg2)発現が低下。 | 図8.マイクロアレイ解析結果の検証。A.視索前核のEP3発現細胞(赤)の90%以上がGABAAg2を発現していた。B.PGE2投与後30分で視索前野のgabr遺伝子発現が低下し、この応答はEP3欠損マウスではみられなかった。 |
3)脂肪細胞の分化成熟におけるプロスタノイドと受容体の役割
プロスタグランジン (PG) E2は、古くから前駆脂肪細胞から脂肪細胞への分化を調節しうることが示されていたのですが、その生理的意義については今もよくわかっていません。しかし ながら、最近、アディポネクチンによる脂肪細胞分化抑制作用は、PGE2により介達されること (Yokota et al. 2002)、またCOX-2変異マウスは脂肪組織のPGE2含量の低下と相関して体重増加と脂肪パッドの増大を示すこと(Fain et al. 2001)などが明らかとなっています。私たちは、インビボの検討に先立って、前駆脂肪細胞3T3-L1にはEP4受容体ならびにPGF2a受容体が主に 発現していること、PGF2a受容体作動薬、PGE2、膜透過性cAMPはいずれも本細胞の脂肪細胞への分化を抑制すること、EP4遮断薬は、PGE2に 拮抗するがPGF2aには影響しなかったこと、さらにインドメタシンやEP4遮断薬でEP4シグナルを阻害すると脂肪細胞分化が亢進することを見いだしま した(図9)(Tsuboi et al. 2004)。一方、3T3-L1の脂肪細胞への分化に対するPGE2、EP4作動薬の効果についてマイクロアレイを用いて比較したところ、分化処理に伴っ て発現変動した1,991遺伝子のうち、907がPGE2によって阻害され、その全てがEP4作動薬で再現されました。この907遺伝子には、PPARや C/EBPをはじめとする脂肪細胞分化を司る遺伝子や、アディポネクチンやレジスチン、脂質代謝酵素など脂肪細胞分化に依存した一連の遺伝子発現が含まれ ていました(図10)(Sugimoto et al. 2004)。またPGE2の分化抑制作用は分化誘導刺激時に、PGF2aによる分化抑制作用は分化後の成熟期にそれぞれ特異的に見られるという報告もみら れます(Xu et al. 2006)。これまで、野生型に比べてEP4受容体欠損マウスの体重が著明に変化するという表現型は得られていませんが、私たちは、生体内でもPGE2- EP4シグナルが脂肪細胞の分化・成熟を制御するような条件が隠れているのではないかと考え、これを調べています。
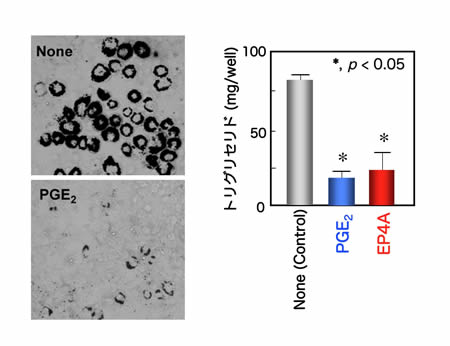
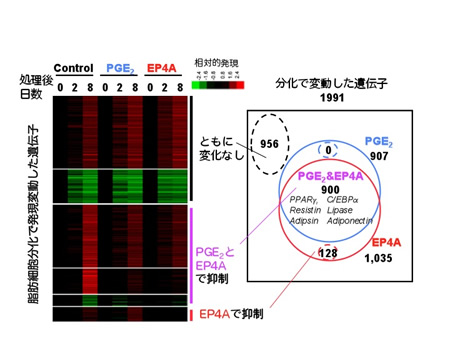
図9. PGE2とEP4作動薬(EP4A)は脂肪細胞分化を抑制する |
図10. PGE2は脂肪細胞分化に伴う遺伝子変動を抑制し、この効果はEP4作動薬で再現される |
4)プロスタグランジンによるマスト細胞機能の調節機構
マスト細胞は末梢組織に点在する免疫細胞で、細胞膜表面上の高親和性FcεRIがIgEを介して抗原を感知すると脱顆粒やメディエーター産生を介してⅠ型アレルギー応答を引き起こします(図11)。
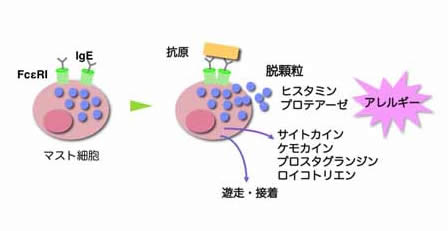
| 図11.マスト細胞のさまざまな機能。 抗原がIgEに結合してIgE受容体(FceRI)を架橋させると、脱顆粒によりヒスタミンやプロテアーゼが放出される。 マスト細胞は活性化されると、リンパ節に移動したり、特定の細胞外マトリクスに接着し、サイトカインやケモカイン、プロスタグランジンやロイコトリエンを産生することで炎症・アレルギーの進展を調節している。 |
マ スト細胞の機能は局所で産生される因子によって調節されるのですが、プロスタグランジンもそのような制御因子の一つと考えられています。実際これまでに、 抗原-IgEによるマスト細胞の脱顆粒応答に対してPGE2が正あるいは負に調節するという結果が報告されています。しかしながら、PGE2が単独でマス ト細胞に作用してその性質を変化させるという報告は見られていません。私たちは、マスト細胞には複数のプロスタグランジン受容体が非常に高いレベルで発現 していることから、プロスタグランジンがマスト細胞の多彩な機能を決定する因子として働くと仮説をたて、これを検証しています。例えば、PGE2は癌化マ スト細胞P-815のフィブロネクチンへの接着を促進するのですが、これにはEP3とEP4の二種類の受容体が協調的に働いていることを見出しています (Hatae et al. 2003)。
5)プロスタグランジンによる子宮収縮の生理的意義
ヒトを含む哺乳動物では、プロスタグランジン(PG)E2、PGF2αは分娩時に子宮で大量に産生され、また子宮平滑筋を強力に収縮させることから、PG は分娩を誘導する生理因子ではないかと考えられてきました。ところが、これまでにシクロオキシゲナーゼの欠損マウス、プロスタグランジン受容体の欠損マウ スを含め、子宮収縮の不具合によって分娩が消失するものは存在せず、PGによる子宮収縮と自然分娩との関係はいまだに不明でした。私たちはこれまでに、 PGF受容体欠損(FPKO)マウスで分娩が消失すること、これは黄体退縮不全によりプロゲステロン分泌が維持されためであること、妊娠末期に本マウスを 卵巣切除すると分娩が回復することを報告しました(Sugimoto et al. 1997)。ところが、FPKOを卵巣切除して誘導される分娩はインドメタシンで内因性のPG産生を阻害することで遅延しました(Tsuboi et al. 2003)。
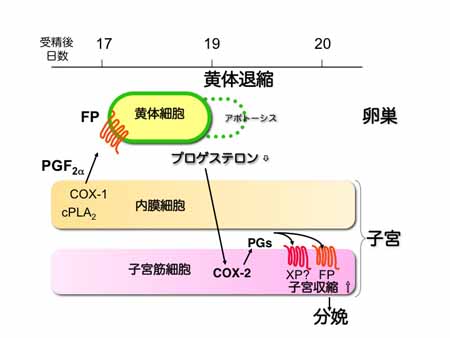
図12.プロスタグランジンは黄体退縮と子宮収縮を時空間的に制御して分娩を誘導する
私たちは、PGは複数の受容体に作用して子宮収縮を引き起こし、生理的な分娩を誘導しているのではないか(図12)と考え、これを検証しています。
6)プロスタグランジンによる受精促進機構:ケモカイン作用の発見
(京都新聞に掲載されました) (PNASのIn This Issueに紹介されました)(雑誌「化学」で紹介されました)
排卵された卵は単独で精子を呼びよせているわけではありません。ヒトを含めた哺乳動物の受精は卵管で起こりますが、ここで卵は護衛隊ともよぶべき卵丘細
胞と、これが産生する細胞外マトリクスによって取り囲まれ、複合体を形成しています。細胞外マトリクスは、排卵時の衝撃やタンパク質分解酵素の攻撃から卵
を守るとともに、受精の際には精子の選別に寄与しています。精子は自らの酵素と運動でマトリクスを容易に分解することができるので、卵に到達することがで
きます。私たちは、卵丘細胞の放出するケモカインが受精に重要な二つの作用をもつことを発見しました。ケモカインは、精子を呼びよせるのと同時に、卵丘マ
トリクスの強度を増して、卵を守っているのです。その後、受精が近づくと、ケモカインの作用はプロスタグランジンによって弱められ、マトリクスは精子の酵
素でうまく分解されるようになります。つまり、ケモカインとプロスタグランジンは互いに拮抗して、卵を取り巻くマトリクスの強度を調節していたのです。
この発見の契機として、私たちは、1999年にプロスタグランジン受容体EP2の欠損マウスが、受精の障害により不妊となることを見出していました。
EP2受容体が卵丘細胞に発現することから、この欠損マウスの受精障害は卵丘細胞の何らかの機能不全に起因するものと考え、卵丘の遺伝子発現プロファイル
を野生型卵丘と比較したところ、ある種のケモカイン遺伝子が10倍以上に活性化していました。ケモカインが受精におよぼす影響について詳細に調べた結果、
ケモカインは精子を誘引すること、さらに卵丘自身に作用して接着分子インテグリンを活性化させ、マトリクス中のフィブロネクチン線維化を引き起こすことを
つきとめました。このような卵丘マトリクスアセンブリーは、排卵後の卵管への移動のときにプロテアーゼや物理刺激から卵を守る上では重要なのですが、受精
の際には逆に、精子が卵に接近するのを妨げるだけでなく、卵丘が接着分子インテグリンを介して精子と結合してしまうのです。PGE2-EP2シグナルはケ
モカインに拮抗することで、卵丘マトリクスの物理バリアとしての働きを緩め、精子が卵へ到達するのを助けています。この成果は、不妊の原因究明や安全な避
妊薬の開発に道を拓くもので、実際、私たちはこういった薬を製薬会社と共同開発しています。
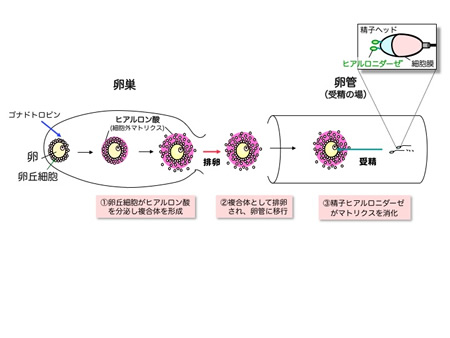
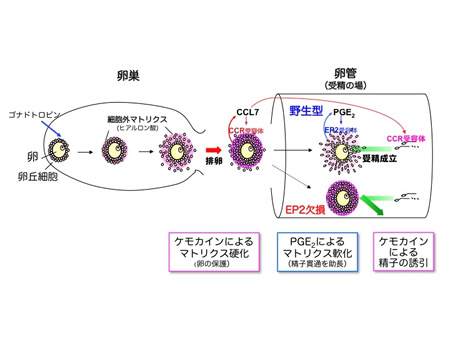
図13.排卵・受精と細胞外マトリクス(ECM) |
図14.ケモカインにより硬化したマトリクス帯をプロスタグランジンが解きほぐす.プロスタグランジンとケモカインが細胞外マトリクスを動的に制御して受精を助ける。 |