| 1)EP4 受容体欠損マウスに見られる分娩直後の死亡 |
|
EP-1,
-2, -3 受容体ヘテロ変異体のかけ合わせにおいて、出生した F2 マウスの野生型・ヘテロ変異体・ホモ変異体の存在比はメンデルの法則
(1:2:1) に従っており、また外観上顕著な異常は観察されません。しかしながら、離乳した F2 マウスの EP4 ホモ変異体は野生型に対し約
5%程度しか存在せず、EP4 ホモ変異体の出生以降の生育過程で致命的な障害のあることが示唆されました。 そこで、このマウスにおける死因の解析を試みました。 |
Fig.1 |
|
Fig.2
|
| 2)EP4 受容体欠損マウスに見られる動脈管閉鎖の異常 |
| 胎児循環系における
EP4 受容体 mRNA の発現解析を行ったところ、動脈管と呼ばれる胎児期特異的に機能する血管平滑筋に大量に発現していることが明らかになりました
(Fig. 3)。動脈管は肺動脈と大動脈をバイパスする血管であり、胎児期では、肺の血管抵抗が高いために循環できない血液がこの動脈管を通り、右心室から直接大動脈に流れ込みます
(Fig. 4)。 |
Fig.3 |
Fig.4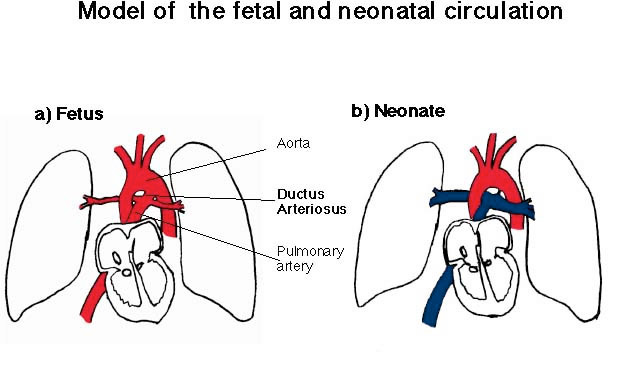 |
|
Fig.5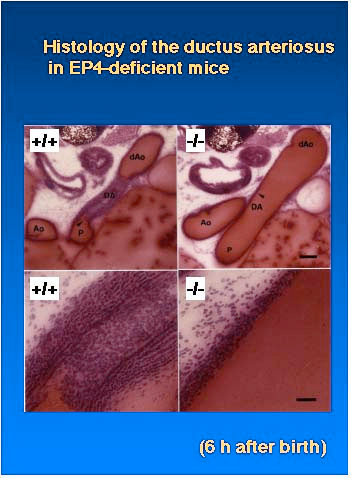 |
| 考察 |
|
まず、EP4受容体欠損マウスの死因について考察します。胎児は呼吸を行う必要がないため肺は肺胞液で満たされており、そのため右心室から送り出された血
液は肺を流れにくく、動脈管を通過し大動脈へと流れ込みます。生後は肺呼吸の開始によって肺血管抵抗が減少し、肺へ血液が流れやすくなり、また動脈管が閉
鎖することで大動脈からの逆流を防ぐことが出来ます。しかしながら、EP4
受容体欠損マウスは生後も動脈管が開いたままのため、左心室から送り出されてきた血液が動脈管を通り肺に流れ込んでしまうと考えられます。欠損マウスで観
察された肺のうっ血はこのような仮説を支持するものです。肺に過度に血液が流れ込むため換気不全を起こすこと、また、肺から左心室へと血液が戻ってしまう
ために左心室に過度の負担がかかり、最終的には左心室不全を引き起こしたものと考えられます (Fig. 6)。 |
Fig.6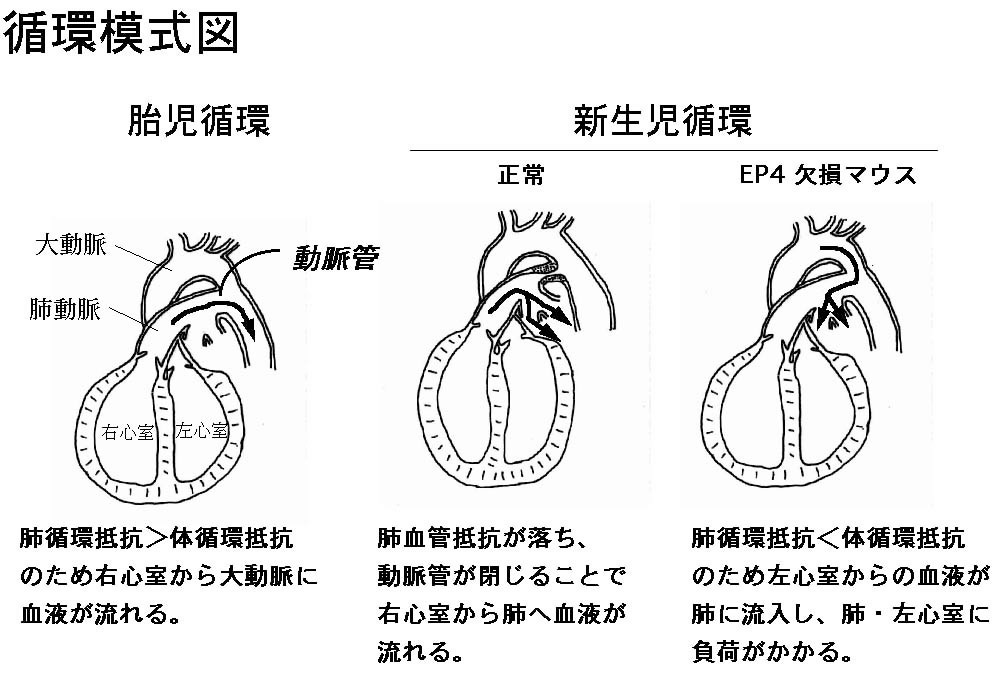 |
| 次に、動脈管における EP4 受容体の役割について考察します。従来より、PG 合成阻害薬であるアスピリンやインドメタシンが動脈管の収縮作用を持つことが知られており、このことから PG が動脈管の弛緩作用を持つことが示唆されてきました。実際、薬理学的に PGE2 が動脈管の弛緩作用を持つことが示されています。また生後の動脈管収縮のメカニズムとして、酸素呼吸に伴う血中 PG の代謝により濃度が減少することにより、弛緩を減弱させ収縮反応を引き起こす可能性が示唆されてきました。そこで、私たちは動脈管特異的に EP4 受容体が発現していることを見出し、動脈管において EP4 が重要な役割を果たすことを示唆しました。 | Fig.7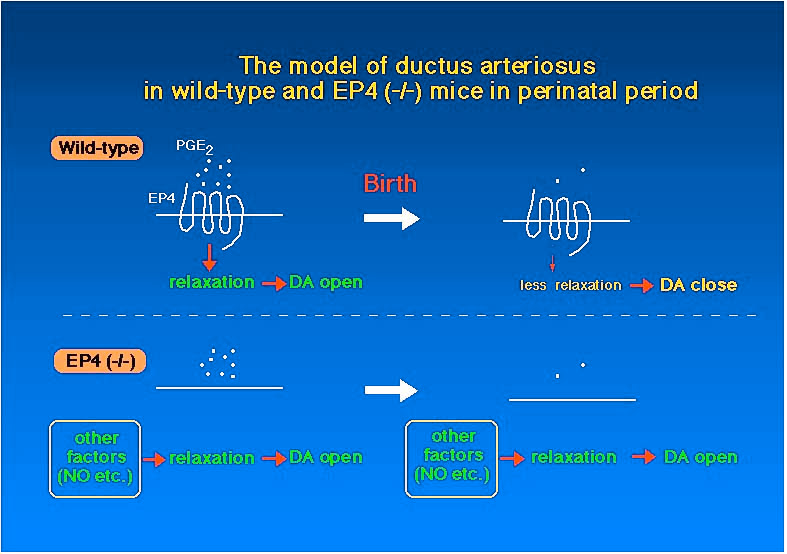 |
|
EP4 受容体がアデニル酸シクラーゼを活性化し、細胞内 cAMP
濃度を上昇させることを介して血管平滑筋弛緩作用を持つことから、動脈管における弛緩作用は EP4
受容体を介していることが示唆されます。このことからEP4
欠損マウスでは動脈管は何らかの異常な収縮を引き起こすという可能性が予想されます。しかしながら、EP4
受容体を欠損させたマウスで表れた表現型は生後における動脈管閉鎖不全であり、収縮能が失われているという結果が得られました。これがどのようなメカニズ
ムで引き起こされているかについては今のところ明らかではありません。しかしながら、一つの仮説としてEP4受容体以外の因子による弛緩作用の補償が考え
られます。この場合、弛緩因子は生後も引き続いて弛緩し続けるために、生後も動脈管が弛緩し続けたのではないかと予想されます (Fig.
7)。 以上、EP4 受容体欠損マウスについての解析により EP4 受容体は胎児動脈管の調節に重要な役割を果たしていることが明らかとなりました。 |
|
| 文献 |
| 1. Segi E et al. Biochem. Biophys. Res. Commun. (1998) 246, 7-12 |
