| 1)EP2 受容体欠損マウスにおける出生数の減少 |
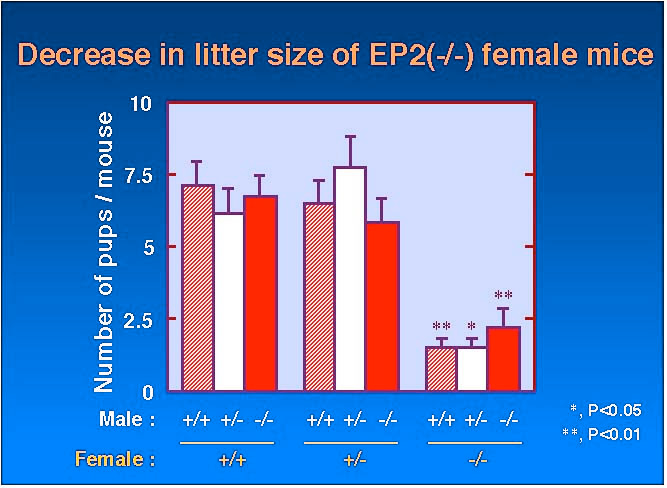
| EP2 受容体欠損マウスは雌の生殖系に異常が観察されました。雌の EP2 ホモ欠損体はその性周期は正常であり妊娠・出産をすることができますが、一腹あたりの出産数が減少しており、1回の妊娠において平均1匹程度しか出生しませんでした。このような同腹仔の減少は妊娠 19 日目においても観察され、野生型は平均 7.1 匹を出生するのに対し、 EP2受容体欠損マウスでは1.5 匹でした (Fig. 1)。このような出生数の減少は妊娠 7 日目の胎児数において確認されることから、それ以前の過程である排卵・受精・受精卵の着床・子宮内膜の脱落膜化に依存した反応と考えられました。 |
Fig.1 |
| 2)生殖生理の解析 |
|
これまでの研究において、 EP2 mRNA が着床期である妊娠 5 日目の子宮上皮細胞に強く発現していることが見出されていたことから、まず
EP2 ホモ欠損体の着床能について検討しました。実験は、偽妊娠 マウスを作製し、その4 日目の子宮に野生型のブラストシストを移植し、妊娠
14 日目に着床数を測定しました。その結果、EP2 ホモ欠損体での着床数は野生型マウスでのそれと同程度であることから、EP2 ホモ欠損体の着床・脱落膜化は正常であると推定しました。 |
Fig.2 |
| 3)EP2、COX-2 発現部位の検討 |
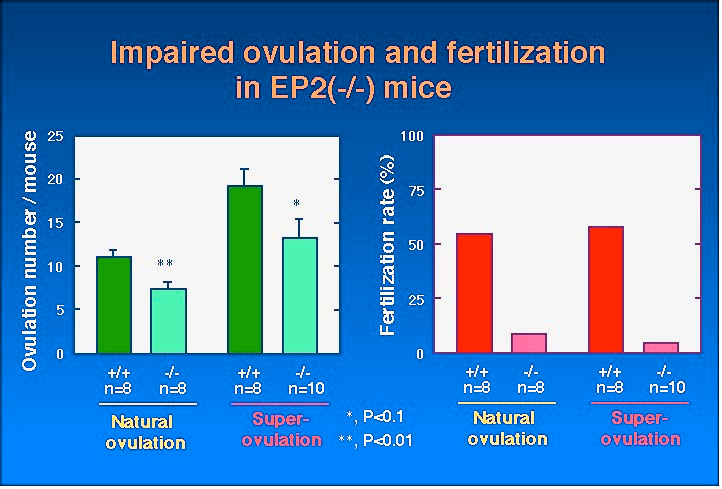
| 過排卵処理した卵巣で EP2 mRNA の発現をシクロオキシゲナーゼ (COX)-2 mRNA の発現と比較して検討したところ (Fig. 3)、妊馬血清ゴナドトロピン (pregnant mare serum gonadotropin; PMSG) 投与後 48 時間において EP2 mRNA は卵胞膜細胞に弱い発現が見られましたが、COX-2 mRNA は発現が見られませんでした。COX-2 mRNA はヒト絨毛性ゴナドトロピン (human chorionic gonadotropin; hCG) 処理後 4 時間において前排卵卵胞の顆粒膜細胞と卵丘細胞に大量に発現し、hCG 処理後 8 時間で顆粒膜細胞において発現は減少していましたが、卵丘細胞においては高いレベルが維持されていました。 EP2 mRNA は hCG 処理後に卵丘細胞に誘導され、その発現は排卵直前の hCG 処理後12 時間まで続いていました。そこで卵丘細胞に焦点をあて、EP2 受容体欠損マウスの解析を行いました。 | Fig.3 |
| 4)卵丘細胞に関する検討 |
| 卵丘細胞は卵の周りを取り囲む細胞であり、卵を保護すると共にその成熟にも関与することが知られています。排卵期と受精期において、卵丘細胞は
expansion という現象を起こします。expansion は卵丘細胞の間隙が広がっていく現象を指し、卵丘細胞からのヒアルロン酸マトリックスの分泌上昇を大きな特徴とします。生体においてはゴナドトロピンの
preovulatory surge によって引き起こされますが、in vitro においても cAMP アナログや卵胞刺激ホルモン (follicle-stimulating
hormone; FSH) あるいは PGE2 によってもこの現象が模倣されることが知られています。 |
Fig.4  |
Fig.5 |
|
Fig.6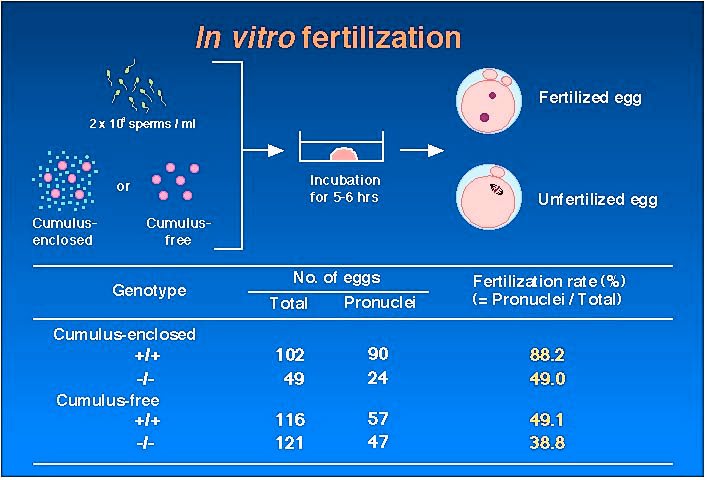 |
| 考察 |
| 今回のEP2受容体欠損マウスの解析から、このマウスでは排卵に軽度の障害が、また受精の過程に重度の障害が存在することが判りました。これらを模式的に示したのがFig.
7です。 |
Fig.7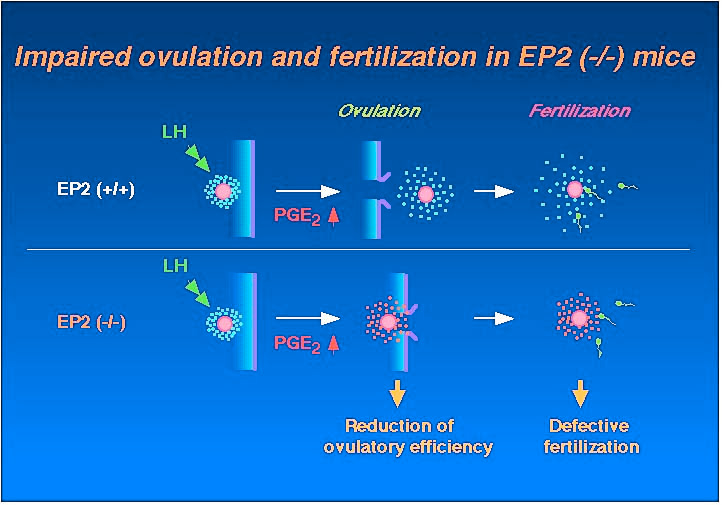 |
| 文献 |
| 1. Hizaki H et al. Proc. Natl. Acad. Sci. U. S. A. 1999; 96:10501-10506 |