-> PDF version
-> presentation file (PDF)
-> Archives of Dr. mn's Research Works
医療変革を目指した網羅的疾患分子病態情報解析法の開発
東京医科歯科大学 情報医科学センター / 医学部附属病院検査部1)
東京医科歯科大学 情報医科学センター2)
東京医科歯科大学 情報医科学センター2)
A Revolutionary Strategy for Systems Biological Analysis of Comprehensive Omics Data
University Center for Information Medicine / Clinical Laboratory, Tokyo Medical and Dental University1)
University Center for Information Medicine, Tokyo Medical and Dental University2)
University Center for Information Medicine, Tokyo Medical and Dental University2)
Abstract:
Comprehensive understanding of molecular pathways of diseases and regulation of them should be indispensable for disease prevention and treatment based on genome information. However most researchers consider that its will take over 50 years to realize it for collecting comprehensive omics data such as transcriptome, metaborome, proteome and cellome and for establishing a methodology to analyze and understand them thoroughly.To reduce that time to one tenth, we applied concept of systems biology to understand disease as distortion of a self-organizing system which consists of whole biomolecules and to omit huge processes required for measuring and understanding factors which have no or little relation to disease pathways. We developed a model for systems omics pathology, in which possible states of whole biomolecules are mapped into a two-dimensional plane and stability of each point is given as a value of the z-axis.Consequently, the model looks like a three-dimensional map with a ball rolling over its surface representing status transition. The map has multiple dimples and grooves connecting them, each of which represents one of healthy or diseased states and one of molecular pathways among them. Structure of the map is defined by genome information and movement of the ball is affected by external factors, for example, through tilting or shaking the plane, blowing the ball, etc. Disease prevention will be achieved by regulating external factors aiming at preventing the ball from rolling out from a healthy dimple. Disease treatment will be replaced by a method to move a ball dropped in one of disease dimples to a healthy dimple.We propose omics medicine based on systems omics pathology as a major descendant of genome medicine in a post-genome era.
Keywords:
systems biology, systems pathology, systems omics pathology, omics medicine, clinical omics
1. はじめに
1.1 ゲノム医療の限界
生命はゲノム、プロテオーム、メタボローム、シグナローム、セロームなどの階層構造を持った要素とそれらの間の有機的連関からなる。当初は生命の設計図であるゲノムがこれらすべての状態を規定していると予想されたが、最近の研究から、実際にはそれら各階層の要素が相互に影響し、かつ外的要因による影響を受けつつ、極めて多様な状態の変化を起こしうることが明らかにされてきた。さらに、ゲノムのうちタンパク質の設計図である遺伝子は数パーセントを占めるに過ぎないが、その他のかなりの部分は調節だけに関わるRNA鎖の設計図であることが最近明らかにされた。
したがって全く同じゲノムを持ったヒトであっても、各要素の状態は偶然や外的要因によって異なった状態に変化する可能性があり、疾病の発症もその状態によって左右されると考えられる。これまで膨大な研究費を費やしてヒトゲノムの全貌が明らかにされ、ポストゲノム時代に入ってその他の生命分子に関する情報の蓄積量が飛躍的に増大したにもかかわらず、それらの研究成果の医療への貢献が期待を大幅に下回っている原因は、このような視点への認識が不十分だったためである。
この状況の打開には二つの課題がある。ひとつは、各階層の要素やそれらの間の相互作用の計測手法を確立することである。ただし、蛋白質を例にとると、生体内における立体構造や糖鎖ひとつひとつの機能の計測すらまだ目処が立っていない。またもうひとつの課題は、生命現象は要素の種類と個数および相互関係の種類があまりにも膨大なため、個体内の各階層の要素を網羅する一元的な解析方法が確立されていないことである。したがって、たとえ一つめの課題を克服し、生命を構成する個々の要素の構造、機能およびそれらの間の関連をすべて明らかにしその情報を積み上げたとしても、その総体としての機能は解明できない。多くの研究者がこのような現状を認識するにつれて、ゲノム情報から疾患発症までのメカニズムが解明され臨床的に使われるのは50年先、などといった悲観的見方が広がっている。
したがって全く同じゲノムを持ったヒトであっても、各要素の状態は偶然や外的要因によって異なった状態に変化する可能性があり、疾病の発症もその状態によって左右されると考えられる。これまで膨大な研究費を費やしてヒトゲノムの全貌が明らかにされ、ポストゲノム時代に入ってその他の生命分子に関する情報の蓄積量が飛躍的に増大したにもかかわらず、それらの研究成果の医療への貢献が期待を大幅に下回っている原因は、このような視点への認識が不十分だったためである。
この状況の打開には二つの課題がある。ひとつは、各階層の要素やそれらの間の相互作用の計測手法を確立することである。ただし、蛋白質を例にとると、生体内における立体構造や糖鎖ひとつひとつの機能の計測すらまだ目処が立っていない。またもうひとつの課題は、生命現象は要素の種類と個数および相互関係の種類があまりにも膨大なため、個体内の各階層の要素を網羅する一元的な解析方法が確立されていないことである。したがって、たとえ一つめの課題を克服し、生命を構成する個々の要素の構造、機能およびそれらの間の関連をすべて明らかにしその情報を積み上げたとしても、その総体としての機能は解明できない。多くの研究者がこのような現状を認識するにつれて、ゲノム情報から疾患発症までのメカニズムが解明され臨床的に使われるのは50年先、などといった悲観的見方が広がっている。
1.2 システム生物学およびシステム病態学の可能性
そのような見方に対して、情報学の観点からは、生命を各要素固有の属性と各々の関係から規定されるひとつのシステムとみなすことができ、その立場から生命を理解しようとするシステム生物学、あるいは疾病を理解しようとするシステム病態学といった学問体系 が発達しつつある。それらは観察により得られたシステム全体の制約条件と、システムの構成要素やそれらの相互関係のうち、測定可能な一部の情報だけを用いて、関心のある機能を制御する因子を確率的に推定するという手法に特徴がある。これをうまく適用し、現時点で入手可能な環境情報、臨床情報および分子病態情報から、疾病の発症、重症化あるいは予後を制御する因子(群)を抽出することに成功すれば、先のあげた二つの課題の克服が期待できる。
1.3 システムオミックス病態学およびオミックス医療の提唱
そこで我々は、疾患を全生体分子の相互関係からなるシステム総体の歪みとして捉え、システム病態学の手法を用いて病因の分子的な経路を網羅的に探索、解明する学問大系をシステムオミックス病態学(systems omics pathology)と呼び、さらにその経路を制御することによって治療や予防につなげるという、従来とは全く異なるアプローチによる医療をオミックス医療(omics medicineまたはcinical omics)と呼ぶことを提唱する 。なお、genome、transcriptome、proteomeなど、生体内各層の生体分子グループ各々の総体を表す共通の接尾語が「-ome」であり、「オミックス(omics)」はgenomics、proteomicsなどのように、それぞれを対象とする研究体系を意味する接尾語に由来している。
2. 目的
システムオミックス病態学の実践には、(1)解析の対象となる全生体分子の階層構造とそれらの間の有機的連関を表現した情報を格納できる網羅的疾患分子病態データベースの構築と、(2)そのデータベースを対象に統計的ノウハウやデータマイニングを駆使して疾患の分子経路を網羅的に探索する手法の開発が必要である(図1、図2)。(1)については本学術集会において別の演題として報告する予定であり、本論文ではおもに(2)を目的とした研究成果について報告する。
3. 方法
ヒトの個体は60兆個とも言われる細胞とその間をつなぐ細胞外マトリックスから構成されており、ひとつひとつの細胞は膨大な種類の分子によって構成されている。しかし、各分子が自由な組み合わせで存在できると仮定した場合に想定される個体の存在様式の多様さと比較して、実際に観察される個体の存在様式は極めて限られている。したがって、各分子が互いに密接に影響し合う結果として、それら全体が構成するシステムが総体として取りうる存在様式には、極めて強固な自律的制約が生まれることが予想される。これは各細胞や臓器の存在様式にも言えることである。そこでまず第1段階として、これまで知られているそのような自律的制約を説明できるような、システムオミックス病態学の大統一理論の基盤となる仮説モデルを構築する。
4. 結果
4.1 細胞内オミックスレベルの病因仮説
・生体分子には重複、バックアップ、補完などの機能的冗長性がある
・細胞内オミクスのシステム全体の取りうる安定状態の数は有限であり、我々はそれらを正常細胞の分化や種類、あるいは病因細胞として認知している
・別の状態への遷移には外部負荷が必要である
・未分化の状態はシステムが高いエネルギー状態にあり、分化すると低いエネルギー状態に移る
・分化した細胞が未分化な細胞に戻ることは稀である
・生体分子に致命的欠陥が生じると安定状態の維持が不可能となるため生存できない
・生体分子の機能的欠陥だけで別の状態に遷移させる力はなく、たとえばエネルギー状態を逆行するときの閾値を低下させる効果、各安定状態における機能の量的な差、細胞の寿命の差として現れる
・細胞内オミクスのシステム全体の取りうる安定状態の数は有限であり、我々はそれらを正常細胞の分化や種類、あるいは病因細胞として認知している
・別の状態への遷移には外部負荷が必要である
・未分化の状態はシステムが高いエネルギー状態にあり、分化すると低いエネルギー状態に移る
・分化した細胞が未分化な細胞に戻ることは稀である
・生体分子に致命的欠陥が生じると安定状態の維持が不可能となるため生存できない
・生体分子の機能的欠陥だけで別の状態に遷移させる力はなく、たとえばエネルギー状態を逆行するときの閾値を低下させる効果、各安定状態における機能の量的な差、細胞の寿命の差として現れる
4.2 セロームレベルの病因仮説
・細胞には重複、バックアップ、補完などの機能的冗長性がある
・セロームのシステム全体の取りうる安定状態の種類はひとつしかないが、その状態の変化にはかなり幅があり、それを人間は体調変化、学習やトレーニング効果、疾病として認知している
・状態の変化に必要な外部負荷には閾値がある
・セロームのシステム全体の取りうる安定状態は大局的に見て時間と共に一定方向への遷移が不可避であり、それを人間が発生は成長・老化の過程、あるいは疾病として認知している
・セロームのシステム全体の取りうる安定状態の種類はひとつしかないが、その状態の変化にはかなり幅があり、それを人間は体調変化、学習やトレーニング効果、疾病として認知している
・状態の変化に必要な外部負荷には閾値がある
・セロームのシステム全体の取りうる安定状態は大局的に見て時間と共に一定方向への遷移が不可避であり、それを人間が発生は成長・老化の過程、あるいは疾病として認知している
4.3 オミックス医療における疾病制御モデル
これらのモデルに、タンパク質のアミノ酸配列からエネルギー的に安定な立体構造を推定する手法を応用することにより、次のような疾病制御モデルの作成に成功した。
生体分子全体の状態について、安定性をZ軸として他のパラメータを2次元平面に写像すると、起伏のある立体地図のようなモデルができ、その表面を起伏に沿って転がる球によって状態の遷移が表現される。この地図には所々に凹みとそれらを結ぶ溝があり、それらは健康あるいは各種疾病の状態とそれらが移行する分子的経路に相当 する。凹みや溝の位置や深さは、まず基本構造がゲノムによって規定され、さらにさまざまな外部因子による修飾を受ける。また球は振動、風あるいは平面の傾きなどに相当する外部因子によって動きが規定される.
このモデルを用いれば、さまざまな疾病に対する易罹患性の個人差は、凹みや溝の違いとして表現され、どのような外部因子が健康状態の凹みから球を動かし、どのような疾病の凹みに落下させ得るかが、定量的に把握できる。疾患の予防は、健康状態にある球がそのような移動をできるだけ起こさないように外部因子を制御することで達成される。また発症した疾患の治療は、疾病の凹みに落ち込んでしまった球を健康状態の凹みへ導く方法を見つけることで達成される。
生体分子全体の状態について、安定性をZ軸として他のパラメータを2次元平面に写像すると、起伏のある立体地図のようなモデルができ、その表面を起伏に沿って転がる球によって状態の遷移が表現される。この地図には所々に凹みとそれらを結ぶ溝があり、それらは健康あるいは各種疾病の状態とそれらが移行する分子的経路に相当 する。凹みや溝の位置や深さは、まず基本構造がゲノムによって規定され、さらにさまざまな外部因子による修飾を受ける。また球は振動、風あるいは平面の傾きなどに相当する外部因子によって動きが規定される.
このモデルを用いれば、さまざまな疾病に対する易罹患性の個人差は、凹みや溝の違いとして表現され、どのような外部因子が健康状態の凹みから球を動かし、どのような疾病の凹みに落下させ得るかが、定量的に把握できる。疾患の予防は、健康状態にある球がそのような移動をできるだけ起こさないように外部因子を制御することで達成される。また発症した疾患の治療は、疾病の凹みに落ち込んでしまった球を健康状態の凹みへ導く方法を見つけることで達成される。
5. 考察
今回我々は、 ゲノムレベルの個人差と疾患の間には、極めて複雑なネットワークが介在するにもかかわらず、結果として恒常性が維持されることを条件に加えると、それらの間には比較的単純な関係が成立する可能性を見いだした。
もしこれが実証されれば、現在の医学医療の基盤を成している、現象論主導の疾患分類、遺伝的個人差のバイアスを無視したメガトライアル、遺伝的個人差を軽視した画一的な疾病予防や治療介入などが、ゲノム情報に基づいて根底から見直しを迫られる。さらにこれまでの研究によって、細胞や組織が取り得る形態にもシステムの強い制約が働いているために、全く異なる分子的病因経路によって生じた病態が類似の形態異常として観察される場合があることが明らかにされており、従来の診療科別医学分類が根底から覆される可能性もある。
したがって我々のアプローチが成功すれば、これまでは医学研究や医療にとって補助的な存在であった情報学が、今後はそれらの変革を主導する情報医学として中心的な役割を担うことが期待される。
もしこれが実証されれば、現在の医学医療の基盤を成している、現象論主導の疾患分類、遺伝的個人差のバイアスを無視したメガトライアル、遺伝的個人差を軽視した画一的な疾病予防や治療介入などが、ゲノム情報に基づいて根底から見直しを迫られる。さらにこれまでの研究によって、細胞や組織が取り得る形態にもシステムの強い制約が働いているために、全く異なる分子的病因経路によって生じた病態が類似の形態異常として観察される場合があることが明らかにされており、従来の診療科別医学分類が根底から覆される可能性もある。
したがって我々のアプローチが成功すれば、これまでは医学研究や医療にとって補助的な存在であった情報学が、今後はそれらの変革を主導する情報医学として中心的な役割を担うことが期待される。
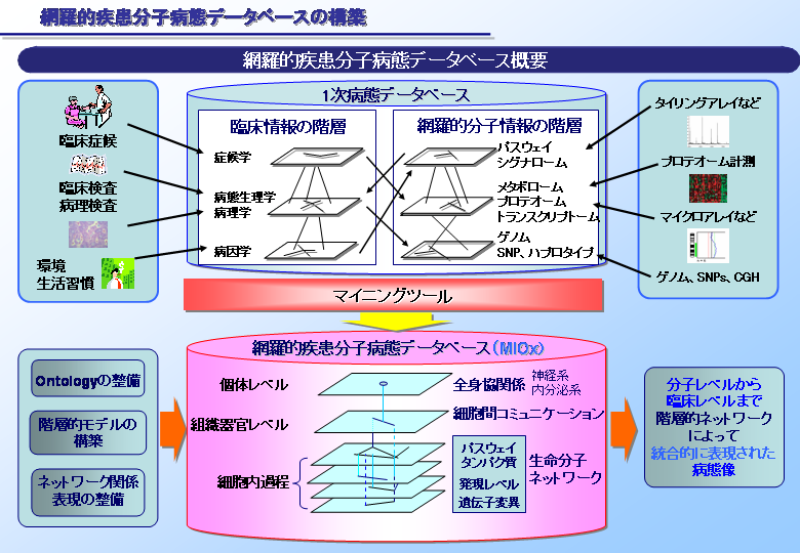 網羅的疾患分子病態データベースの構築とデータマイニング
網羅的疾患分子病態データベースの構築とデータマイニング
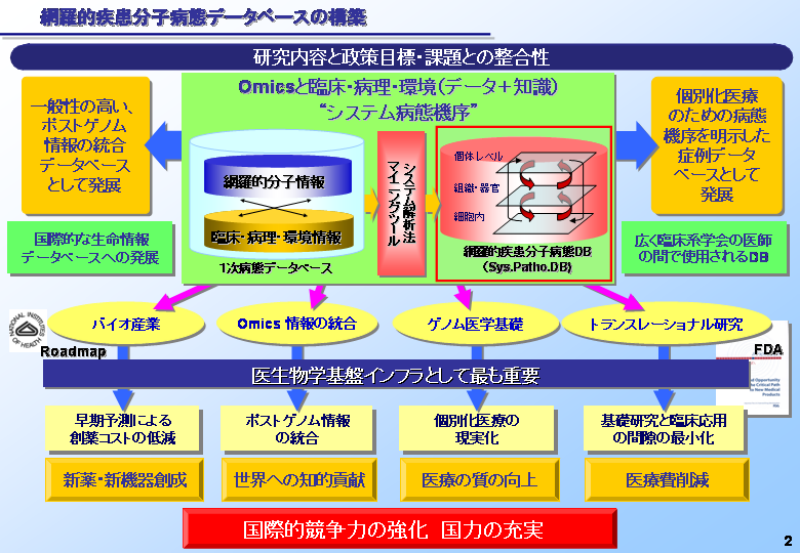 網羅的疾患分子病態データベースの意義
網羅的疾患分子病態データベースの意義